
【题目】将一定体积的某NaOH溶液分成两等份,一份用![]() 的一元酸HA溶液中和,消耗酸溶液的体积为
的一元酸HA溶液中和,消耗酸溶液的体积为![]() ;另一份用
;另一份用![]() 的一元酸HB溶液中和,消耗酸溶液体积为
的一元酸HB溶液中和,消耗酸溶液体积为![]() ,则下列叙述正确的是
,则下列叙述正确的是![]()
![]()
A.若![]() ,则说明HA的酸性比HB的酸性强
,则说明HA的酸性比HB的酸性强
B.若![]() ,则说明HA的酸性比HB的酸性弱
,则说明HA的酸性比HB的酸性弱
C.因为两种酸溶液的pH相等,故![]() 一定等于
一定等于![]()
D.若将两种酸溶液等体积混合,混合溶液的pH一定等于2
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】常温下,向1L0.1mol/LH2A溶液中逐滴加入等浓度NaOH溶液,所得溶液中含A元素的微粒的物质的量分数与溶液pH的关系如图,下列说法中正确的是( )
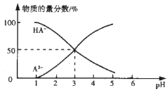
A.H2A的电离方程式为H2A=HA-+H+ HA-A2-+H+
B.室温下,Na2A水解平衡常数Kh=10-11
C.0.1mol/LNaHA溶液中存在c(A2-)+c(HA-)<0.1mol/L
D.常温下,等物质的量浓度NaHA与Na2A溶液等体积混合后溶液的pH=3.0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制适合的条件,将反应2Fe3++2I-![]() 2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是( )
2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是( )
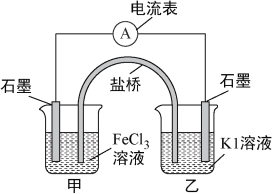
A. 反应开始时,乙中石墨电极上发生氧化反应
B. 反应开始时,甲中石墨电极上Fe3+被还原
C. 电流计读数为零时,反应达到化学平衡状态
D. 电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极
查看答案和解析>>
科目:高中化学 来源: 题型:
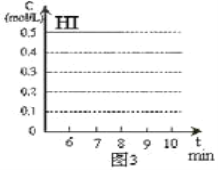
【题目】将在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:2HI(g)![]() H2(g)+ I2(g)△H> 0反应中各物质的浓度随时间变化情况如图1:
H2(g)+ I2(g)△H> 0反应中各物质的浓度随时间变化情况如图1:
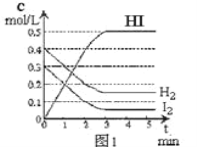
(1)该反应的化学平衡常数表达式为_________。
(2)根据图1数据,反应开始至达到平衡时,平均速率v(HI)为_________
(3)反应达到平衡后,第8分钟时:
①若升高温度,化学平衡常数K_________(填写增大、减小或不变)HI浓度的变化正确_________(用图2中a-c的编号回答)
②若加入I2,H2浓度的变化正确的是_________,(用图2中d-f的编号回答)
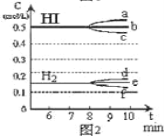
(4)反应达到平衡后,第8分钟时,若反容器的容积扩大一倍,请在图3中画出8分钟后HI浓度的变化情况___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种简单的原电池装置如下图所示。据图回答下列问题。
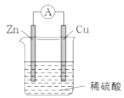
(1)锌是该电池的_______(填“正”或“负”)极。Zn片上发生的电极反应为_______。Cu片上发生的电极反应为__________。能证明化学能转化为电能的实验现象为______。
(2)装置中稀硫酸的作用是_______。
A.电极材料 B.电极反应物 C.电子导体 D.离子导体
(3)某原电池的总反应是Zn+Cu2+=Zn2++Cu,该原电池的正确组成是______。
A.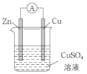 B.
B. C.
C. D.
D.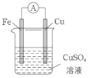
(4)从化学的角度分析,原电池装置产生电流的原因是:原电池装置可将____,并通过能导电的物质形成闭合回路,产生电流
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100 mL 0.01 molL﹣1 HA溶液中逐滴加入0.02 molL﹣1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况,下列说法不正确的是
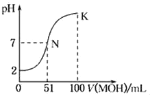
A. HA为一元强酸,MOH为一元弱碱
B. N点溶液中离子浓度大小关系为:c(M+)=c(A﹣)>c(H+)=c(OH﹣)
C. N点水的电离程度大于K点水的电离程度
D. N→K之间曲线上任意一点都有c(M+) >c(OH﹣)>c(A﹣)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,在某物质的溶液中,由水电离出的
时,在某物质的溶液中,由水电离出的![]() ,下列说法正确的是( )
,下列说法正确的是( )
A.![]() 时,水的电离受到抑制
时,水的电离受到抑制
B.![]() 时,水的电离受到抑制
时,水的电离受到抑制
C.![]() 时,溶液的pH一定为a
时,溶液的pH一定为a
D.![]() 时,溶液的pH一定为
时,溶液的pH一定为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )

A.化学平衡发生移动,平衡常数不一定发生变化
B.升高温度会增大化学反应速率,原因是增加了活化分子的百分数
C.某化学反应的能量变化如上图所示,则该反应的△H>0,△S>0
D.H3PO4的电离常数:K1>>K2>>K3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pK=-lgK,25℃时,二元酸H2A的pK1=1.85,pK2=7.19。25℃时,用0.1mol/LNaOH溶液滴定20mL0.1mol/LH2A溶液的滴定曲线如图所示。下列说法正确的是

A. a点所得溶液中:Vo=10mL
B. C点所得溶液中:c(A2-)=c(HA-)
C. b点所得溶液中:c(H2A)+c(H+)=c(HA-)+c(OH-)
D. d点所得溶液中:A2-的水解平衡常数K1=1×10-7.19
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com