
【题目】下列叙述不正确的是( )

A.化学平衡发生移动,平衡常数不一定发生变化
B.升高温度会增大化学反应速率,原因是增加了活化分子的百分数
C.某化学反应的能量变化如上图所示,则该反应的△H>0,△S>0
D.H3PO4的电离常数:K1>>K2>>K3
科目:高中化学 来源: 题型:
【题目】将一定体积的某NaOH溶液分成两等份,一份用![]() 的一元酸HA溶液中和,消耗酸溶液的体积为
的一元酸HA溶液中和,消耗酸溶液的体积为![]() ;另一份用
;另一份用![]() 的一元酸HB溶液中和,消耗酸溶液体积为
的一元酸HB溶液中和,消耗酸溶液体积为![]() ,则下列叙述正确的是
,则下列叙述正确的是![]()
![]()
A.若![]() ,则说明HA的酸性比HB的酸性强
,则说明HA的酸性比HB的酸性强
B.若![]() ,则说明HA的酸性比HB的酸性弱
,则说明HA的酸性比HB的酸性弱
C.因为两种酸溶液的pH相等,故![]() 一定等于
一定等于![]()
D.若将两种酸溶液等体积混合,混合溶液的pH一定等于2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
i.CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1
CH3OH(g)+H2O(g) △H1
ii.CO(g)+2H2(g)![]() CH3OH(g) △H2
CH3OH(g) △H2
iii.CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
(1)已知反应ii中的相关的化学键键能(“C![]() O”表示CO的化学键)数据见表:由此计算△H2=___kJ·mol-1。
O”表示CO的化学键)数据见表:由此计算△H2=___kJ·mol-1。
(2)反应i、ii、iii对应的平衡常数K1、K2、K3之间的关系式为___。
(3)一定条件下,在2L的恒容密闭容器中充入1molCO2和2molH2发生反应i。图1是反应体系中CO2的平衡转化率与温度的关系曲线。

①当温度为500K时,该反应10min达到平衡。0~10min时间内用CH3OH表示该反应的化学反应速率为___。
②若改充入1molCO2和3mol H2,则图1中的曲线会___(填“上移”或“下移”)。
(4)某温度下在容积为2L的密闭容器中充入1molCO和2molH2合成甲醇,发生反应ii,各组分物质的量随时间的变化情况如图2所示。
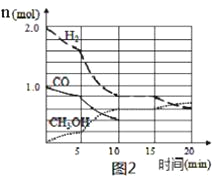
①5min至10min时速率变化的原因可能是___;
②若该反应在恒温恒压下进行,能说明该反应达到平衡状态的是___;
A.单位时间内消耗CO的浓度与生成CH3OH的浓度相等
B.混合气体的密度不变
C.CO和H2的体积分数之比不变
D.混合气体的平均相对分子质量不变
③15min时,增加反应体系中CO的物质的量(其他条件不变),至20min时反应重新达到平衡;则新加入的CO的物质的量为___mol(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A.具有相同通式的有机物不一定互为同系物
B.分子组成相差一个或若干个CH2原子团的化合物一定互为同系物
C.分子式为C3H8与C6H14的两种有机物一定互为同系物
D.两个相邻同系物的相对分子质量数值一定相差14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(HCHO)与葡萄糖相似具有强还原性,40%甲醛溶液沸点为96℃,易挥发。为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下研究。
(1)在如图装置中进行实验,向a中加入0.5mol/LCuSO4溶液50mL和5mol/LNaOH溶液100mL,振荡,再加入40%的甲醛溶液40mL,缓慢加热a,在65℃时回流20分钟后冷却至室温。反应过程中观察到有棕色固体生成,最后变成红色,并有气体产生。

①仪器a的名称是__,仪器b的作用为__。
②能说明甲醛具有还原性的实验现象是__。
(2)查阅资料发现气体产物是副反应产生的。为确认气体产物含H2不含CO,将装置A和如图所示的装置连接后进行实验。

①依次连接的合理顺序为A→B→___→____→___→___→G;___
②装置B的作用是___;
③确认气体产物中含H2而不含CO的现象是___。
(3)已知:![]()
![]()
![]()
![]()
![]() 。设计实验证明a中甲醛的碳元素未被氧化成+4价的实验方案为:取少量a中反应后的清液,___,则说明甲醛的碳元素未被氧化成+4价。
。设计实验证明a中甲醛的碳元素未被氧化成+4价的实验方案为:取少量a中反应后的清液,___,则说明甲醛的碳元素未被氧化成+4价。
(4)为研究红色固体产物的组成,进行如下实验(以下每步均充分反应):

已知:i:Cu2O![]() [Cu(NH3)4]+(无色)
[Cu(NH3)4]+(无色)![]() [Cu(NH3)4]2+(蓝色)。
[Cu(NH3)4]2+(蓝色)。
ⅱ:2Cu+8NH3·H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O
将容量瓶ii中的溶液稀释100倍后,溶液的颜色与容量瓶i相近。由此可知固体产物的组成及物质的量之比约为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ![]()
A.某二元酸![]() 在水中的电离方程式是:
在水中的电离方程式是:![]() ,
,![]() ;则NaHA溶液中:
;则NaHA溶液中:![]()
B.相同温度下将足量氯化银固体分别放入相同体积的①蒸馏水、②![]() 盐酸、③
盐酸、③![]() 氯化镁溶液、④
氯化镁溶液、④![]() 硝酸银溶液中,
硝酸银溶液中,![]() 为①>④=②>③
为①>④=②>③
C.常温下,某溶液的![]() ,则该物质一定是酸或强酸弱碱盐
,则该物质一定是酸或强酸弱碱盐
D.若![]() 、
、![]() 、
、![]() 分别表示常温下
分别表示常温下![]() 的电离平衡常数、
的电离平衡常数、![]() 的水解平衡常数和水的离子积常数,则三者之间的关系为
的水解平衡常数和水的离子积常数,则三者之间的关系为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢镍电池是近年开发出的可充电电池,电池的总反应式为1/2 H2 + NiO(OH) ![]() Ni(OH)2 ,下列叙述正确的是( )
Ni(OH)2 ,下列叙述正确的是( )
A.电池充电时,Ni元素被还原B.电池放电时,镍元素被氧化
C.电池充电时,只有H元素被氧化D.电池放电时,氢气中氢元素被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池可净化废水,同时还能获得能源或有价值的化学产品,图1为其工作原理,图2为废水中Cr2O72-浓度与去除率的关系。下列说法不正确的是( )
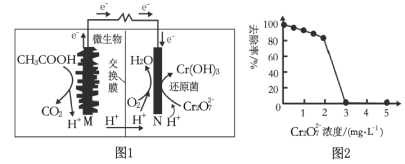
A.图1燃料电池工作一段时间后,N极附近的溶液pH增大
B.外电路转移2 mol电子时,N极消耗标准状况下11.2 L O2
C.图2中Cr2O72-浓度较大时,其去除率下降可能是Cr2O72-浓度较大造成还原菌失活所致
D.M极为电池负极,发生的电极反应为CH3COOH+2H2O-8e-=2CO2↑+8H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com