
【题目】下图是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
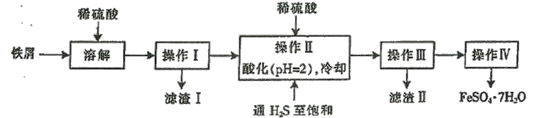
已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6,FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。根据以上流程图,下列说法不正确的是
A.操作I所得滤液中不含有Fe3+
B.操作Ⅱ中用硫酸酸化至pH=2的主要目的是抑制Fe2+的水解
C.操作Ⅱ中,通入H2S至饱和的目的是使Sn2+转化为SnS沉淀并防止Fe2+被氧化。
D.操作Ⅳ中所得的晶体最后用乙醇洗去晶体表面附着的水分。
【答案】B
【解析】
加稀硫酸目的是为了溶解铁屑,再通过过滤得到硫酸亚铁溶液,通入硫化氢是为了沉淀Sn2+,但是饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6,FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5,所以加入稀硫酸调节pH为2,此时Sn2+转变为SnS,通过过滤的方式除去,最后通过降温结晶的方式得到纯净绿矾。
A、虽然杂质含有氧化铁可与稀硫酸反应产生Fe3+,但是含有过量的铁单质,可与Fe3+反应生成Fe2+,所以操作I所得滤液中不含有Fe3+,故A正确;
B、由分析可知,操作Ⅱ中用硫酸酸化至pH=2的主要目的是使Fe2+不能沉淀,故B错误;
C、由分析可知,操作Ⅱ中,通入H2S至饱和的目的是使Sn2+转化为SnS沉淀并防止Fe2+被氧化,故C正确;
D、用乙醇作为洗涤剂的好处是:降低绿矾溶解度、更易挥发。所以操作Ⅳ中所得的晶体最后用乙醇洗去晶体表面附着的水分,故D正确;
故选B。


科目:高中化学 来源: 题型:
【题目】用惰性电极电解1.0 L c(Cl-)=3.0 mol/L的CuCl2、NaCl混合溶液,一段时间后,两极均收集到56.0 L的气体(标准状况下)。下列说法正确的是( )
A.阳极只收集到Cl2
B.电解前溶液呈弱酸性,电解结束后,溶液的酸性增强
C.整个过程中共转移电子5 mol
D.原混合溶液中c(Cu2+)=1.0 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有BaCl2和KCl的混合溶液VL,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀,消耗amolH2SO4;另一份滴加AgNO3溶液,消耗bmolAgNO3使Cl-完全沉淀。原混合溶液中的K+的物质的量浓度为____mol·L-1。
(2)一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则与1molCr3+反应所需PbO2的物质的量为____mol;
(3)在一定条件下,实验室分别以过氧化氢、高锰酸钾、氯酸钾、过氧化钠为原料制取氧气,当制得同温同压下相同体积的氧气时,四个反应中转移的电子数之比为_____。
(4)自来水中的NO3-对人类健康产生危害。为了降低自来水中NO3-的浓度,某研究人员提出在碱性条件下用Al粉还原NO3-,产物是N2。发生的反应可表示如下,请完成方程式的配平:
___Al+___NO3-+___—___AlO2-+___N2↑+___H2O
(5)某化学反应的反应物和产物:KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O
①该反应的氧化产物是____。
②若该反应方程式中I2和KIO3的计量数分别是6和3,则生成1molI2时,转移电子的物质的量为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表是元素周期表的一部分。
H | He | ||||||
Li | Be | B | C | N | O | F | Ne |
Na | Mg | Al | Si | P | S | Cl | Ar |
请回答下列问题。
(1)非金属性最强的元素名称为___________,它位于元素周期表中的位置___________。
(2)硅元素的原子结构示意图是____________,其最高价氧化物是____________(填“酸性”或“碱性”)氧化物。
(3)硼酸(H3BO3)的酸性_________(填“>” 或“<”)碳酸(H2CO3)的酸性,说明你判断的理由:__________________________。
(4)NH3的电子式为________________,它属于____________(填“离子”或“共价”)化合物。NH3的还原性_________(填“>” 或“<”)PH3的还原性。
(5)第三周期元素的最高价氧化物对应的水化物中,有一种物质既能与强酸反应又能与强碱反应,写出这种物质跟氢氧化钠溶液反应的化学方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.分子式为C15H16O2的部分同分异体中可能含有联苯结构单元
B.1.0 mol的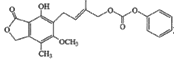 最多能与含5.0 mol NaOH的水溶液完全反应
最多能与含5.0 mol NaOH的水溶液完全反应
C.乳酸薄荷醇醋(![]() )能发生水解、氧化、消去反应
)能发生水解、氧化、消去反应
D.CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,1H-NMR谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用1H-NMR来鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙腈主要用于有机合成及生产医药,农药的中间体,对环境有危害。常温常压下,苯乙腈水解一般需加入酸碱催化剂。但研究人员发现,在近临界水(指温度在523~623K之间的压缩液态水)中,不加任何催化剂的情况下,苯乙腈就能发生水解反应生成苯乙酞胺:
C6H5CH2CN(l)+H2O(l)![]() C6H5CH2CONH2(l) △H
C6H5CH2CONH2(l) △H
(苯乙腈) (苯乙酰胺)
请回答下列问题:
(1)己知近临界水中,水的离子积常数为10-10,则此条件下,pH=7的NaAc溶液中由水电离的c(H+)=________ mol·L-1。该反应不加任何催化剂就能发生的主要原因是___________。
(2)研究反应的平衡常数(记作lgK)与温度(T)的关系,得到如图1所示的关系,判断该反应的△H__________0(填“>”“<”或“=”)。
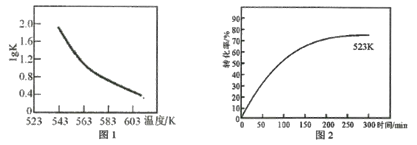
(3)图2表示其他条件不变时,温度和时间对苯乙腈转化率的影响曲线图(不完整)。若图中曲线对应的温度为523K,请你在原图中作出温度为583K的影响曲线。___________。
(4)下列哪种仪器可用于分析水解反应过程中苯乙腈浓度的变化_________(填编号)。
A.元素分析仪 B.核磁共振仪 C.原子吸收光谱仪 D.分光光度计
(5)科学家还在近临界水中分别添加CO2、NH3,研究后得到了如下的图示:
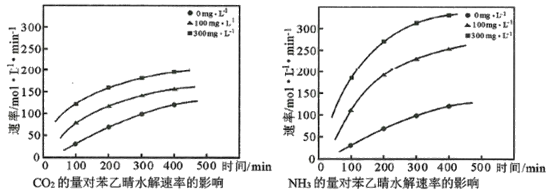
从中你可以得出什么结论(至少写出2点___________。
(6)水的用途很广,可利用太阳能光伏电池电解水制高纯氢,工作示意图如图。通过控制开关连接K1或K2,可交替得到H2和O2。
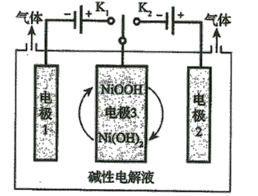
①制H2时,连接______________,可得H2。
②改变开关连接方式,产生O2的电极反应式__________________________。
③选用NiOOH、Ni(OH)2作为电极3材料的优点(请结合电极反应式进行阐述)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,0.1 mol![]() 溶于水,转移的电子数目为0.1
溶于水,转移的电子数目为0.1![]()
B.标准状况下,2.24 L氧气与2.3 g金属钠充分反应,转移的电子数为0.4![]()
C.64 g 铜粉与足量硫粉混合加热充分反应,转移电子数为![]()
D.18 g![]() 含有10
含有10![]() 个中子
个中子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 mol浓硫酸溶于水时包含两个过程:一是部分硫酸分子分散在水里吸收热量,热效应为Δ![]() ;二是部分硫酸分子与水作用形成硫酸水化物释放热量,热效应为Δ
;二是部分硫酸分子与水作用形成硫酸水化物释放热量,热效应为Δ![]() ,其中具体包含以下三个变化:①
,其中具体包含以下三个变化:①![]()
![]() ·
·![]() Δ
Δ![]() =Δ
=Δ![]()
②![]() ·
·![]()
![]() Δ
Δ![]() =Δ
=Δ![]()
③![]()
![]() Δ
Δ![]() =Δ
=Δ![]()
下列说法正确的是
A.浓硫酸溶于水只有化学变化
B.Δ![]() Δ
Δ![]() <0
<0
C.Δ![]() <0
<0
D.Δ![]() =Δ
=Δ![]() +Δ
+Δ![]() +Δ
+Δ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备1,2-二溴乙烷的反应原理如下:![]()
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:有关数据列表如下:
回答下列问题:
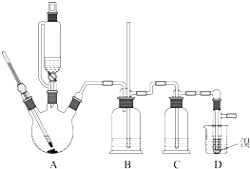
乙醇 | 1,2—二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g.cm-3- | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
【1】在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是______;(填正确选项前的字母)
a 引发反应 b 加快反应速度 c 防止乙醇挥发 d 减少副产物乙醚生成
【2】装置B的作用_____________。
【3】在装置C中应加入______,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)
a 水 b 浓硫酸 c 氢氧化钾溶液 d 饱和碳酸氢钠溶液
【4】判断该制备反应已经结束的最简单方法是___________;将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在______层(填“上”、“下”);
【5】若产物中有少量未反应的Br2,最好用________洗涤除去;若产物中有少量副产物乙醚,可用____的方法除去;
【6】反应过程中应用冷水冷却装置D,其主要目的是_______;
【7】但又不能过度冷却(如用冰水),其原因是_______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com