
【题目】用惰性电极电解1.0 L c(Cl-)=3.0 mol/L的CuCl2、NaCl混合溶液,一段时间后,两极均收集到56.0 L的气体(标准状况下)。下列说法正确的是( )
A.阳极只收集到Cl2
B.电解前溶液呈弱酸性,电解结束后,溶液的酸性增强
C.整个过程中共转移电子5 mol
D.原混合溶液中c(Cu2+)=1.0 mol/L
【答案】D
【解析】
用惰性电极电解1.0 L c(Cl-)=3.0 mol/L的CuCl2、NaCl混合溶液,一段时间后,两极均收集到56.0L的气体(标准状况下),气体物质的量为![]() ,
,![]() ,则阳极上Cl-先放电生成氯气,
,则阳极上Cl-先放电生成氯气,![]() ,则Cl-放电后,OH-放电,且生成氧气1mol;阴极上Cu2+先放电,然后H+放电,且生成氢气2.5mol,再根据阴阳两极得失电子守恒进行计算。
,则Cl-放电后,OH-放电,且生成氧气1mol;阴极上Cu2+先放电,然后H+放电,且生成氢气2.5mol,再根据阴阳两极得失电子守恒进行计算。
A. 经分析知,阳极收集到气体共2.5mol,而溶液中Cl-共3mol,生成氯气共1.5mol,则Cl-放电后,OH-放电,且生成氧气1mol,A项错误;
B. 经分析可知,整个电解过程应分为三个阶段:CuCl2![]() Cu+Cl2↑,2NaCl+2H2O
Cu+Cl2↑,2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,2H2O
2NaOH+H2↑+Cl2↑,2H2O![]() H2↑+O2↑,电解结束后,溶液的碱性增强,B项错误;
H2↑+O2↑,电解结束后,溶液的碱性增强,B项错误;
C. 经分析知,阳极生成氯气1.5mol,则Cl-放电后,OH-放电,且生成氧气1mol,则阳极失电子总物质的量为:![]() ,则整个过程中共转移电子7 mol,C项错误;
,则整个过程中共转移电子7 mol,C项错误;
D. 根据得失电子守恒知,阴极得电子数等于阳极失电子数,则阴极得电子物质的量为7mol,经计算阴极生成氢气为2.5mol,那么H+得电子物质的量为5mol,则Cu2+得电子物质的量为2mol,n(Cu2+)=1.0 mol,原混合溶液中![]() ,D项正确;
,D项正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 丙烷和丁烷互称为同系物
B. ![]() 的名称为3-甲基丁烷
的名称为3-甲基丁烷
C. 沸点:正丁烷>异丁烷>丙烷
D. CH3CH2CH2CH3和CH3CH(CH3)2互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)具有复合官能团的复杂有机物,其官能团具有各自的独立性,在不同条件下所具有的化学性质可分别从各官能团讨论。如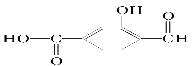 具有三种官能团:______、__________和__________(填官能团的名称),所以这个化合物可看作______类,______类和______类。
具有三种官能团:______、__________和__________(填官能团的名称),所以这个化合物可看作______类,______类和______类。
(2)羟基的电子式是___________________________。
(3)(CH3CH2)2C(CH3)2的名称为_________________________。
(4)2-甲基-1,3-丁二烯的键线式___________________________。
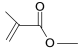
(5)![]() 该有机物发生加聚反应后,所得产物的结构简为______。
该有机物发生加聚反应后,所得产物的结构简为______。
(6) 分子式为_______________________结构简式为______________________。
分子式为_______________________结构简式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数的值。下列说法正确的是( )
A.一定条件下,3molH2和1molN2充分反应后,可得2NA个NH3分子
B.室温下,1LpH=1的HCl溶液中,由水电离的H+数目为0.1NA
C.0.1mol金属Na在空气中完全氧化生成Na2O和Na2O2,转移的电子数为0.1NA
D.1mol/L的NaCN溶液中含CN-和HCN的数目之和为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L的密闭容器中,发生以下反应:2A(g)+B(g) ![]() 2C(g)+D(g),若最初加入的A和B都是4 mol,在前10 s A的平均反应速率为0.12 mol/(L·s),则10 s时,容器中B的物质的量是( )
2C(g)+D(g),若最初加入的A和B都是4 mol,在前10 s A的平均反应速率为0.12 mol/(L·s),则10 s时,容器中B的物质的量是( )
A.3.4 molB.3.2 molC.2.8 molD.1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AG表示溶液酸度:![]() 。常温下,用0.1mol/L的NaOH溶液滴定25 ml 0.1mol/L的CH3COOH滴定结果如图所示,下列分析正确的是()
。常温下,用0.1mol/L的NaOH溶液滴定25 ml 0.1mol/L的CH3COOH滴定结果如图所示,下列分析正确的是()
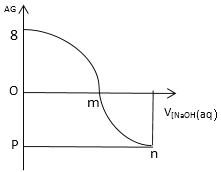
A.0.1mol/L的 CH3COOH溶液的pH=3
B.m点加入NaOH的体积为25mL
C.若pH=7,则溶液中水电离的c(OH-)=1.0×10-3.5 mol/L
D.随着NaOH溶液滴入,溶液中水的电离程度逐渐增大,m点最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅及其化合物在材料领域中应用广泛。回答下列问题:
(1)硅单质有晶体硅和无定形硅两种,区别晶体硅和无定形硅的科学方法是___________
(2)基态硅的价电子排布式为_________,其核外电子的运动状态有_____种。
(3)CCl4和SiCl4常温下均呈液态,SiCl4熔沸点较高的原因为________CCl4不水解,但SiCl4遇水即强烈水解,则SiCl4水解的化学方程式为__________。
(4)SiF4的热稳定性比SiCl4强的原因是 ____。
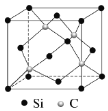
(5)碳化硅(SiC)的结构与金刚石类似,碳化硅的硬度仅次于金刚石,其晶胞结构如图所示。则Si原子的配位数为_______,若晶体的密度为ρg/cm3![]() ,阿伏伽德罗常数为NA,则距离最近的Si原子与C原子之间的距离为_______________cm。(用ρ和NA的式子表示)
,阿伏伽德罗常数为NA,则距离最近的Si原子与C原子之间的距离为_______________cm。(用ρ和NA的式子表示) ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行有关铜、硝酸、硫酸化学性质的实验,实验过程如图所示:
实验1 | 实验2 |
|
|
①、③中溶液呈蓝色,试管口有红棕色气体产生 | ③中溶液呈蓝色,试管口有红棕色气体产生 |
下列说法正确的是
A. 稀硝酸一定被还原为NO2
B. 实验1-②中溶液存在:c(Cu2+) + c(H+) =c(NO3-) + c(OH-)
C. 由上述实验得出结论:常温下,Cu既可与稀硝酸反应,也可与稀硫酸反应
D. 实验1-③、实验2-③中反应的离子方程式:3Cu+2NO3-+8H+ =3Cu2++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
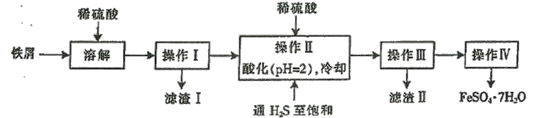
已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6,FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。根据以上流程图,下列说法不正确的是
A.操作I所得滤液中不含有Fe3+
B.操作Ⅱ中用硫酸酸化至pH=2的主要目的是抑制Fe2+的水解
C.操作Ⅱ中,通入H2S至饱和的目的是使Sn2+转化为SnS沉淀并防止Fe2+被氧化。
D.操作Ⅳ中所得的晶体最后用乙醇洗去晶体表面附着的水分。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com