
【题目】硅及其化合物在材料领域中应用广泛。回答下列问题:
(1)硅单质有晶体硅和无定形硅两种,区别晶体硅和无定形硅的科学方法是___________
(2)基态硅的价电子排布式为_________,其核外电子的运动状态有_____种。
(3)CCl4和SiCl4常温下均呈液态,SiCl4熔沸点较高的原因为________CCl4不水解,但SiCl4遇水即强烈水解,则SiCl4水解的化学方程式为__________。
(4)SiF4的热稳定性比SiCl4强的原因是 ____。
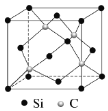
(5)碳化硅(SiC)的结构与金刚石类似,碳化硅的硬度仅次于金刚石,其晶胞结构如图所示。则Si原子的配位数为_______,若晶体的密度为ρg/cm3![]() ,阿伏伽德罗常数为NA,则距离最近的Si原子与C原子之间的距离为_______________cm。(用ρ和NA的式子表示)
,阿伏伽德罗常数为NA,则距离最近的Si原子与C原子之间的距离为_______________cm。(用ρ和NA的式子表示) ![]()
【答案】X—射线衍射实验 3s23p2 14 CCl4和SiCl4均为分子晶体,SiCl4相对分子质量大,范德华力大,熔沸点高 SiCl4 + 3H2O = H2SiO3 + 4HCl F原子半径小与Cl原子,故SiF4键能大于SiCl4 4 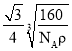
【解析】
(1)区别晶体硅和无定形硅的科学方法是X—射线衍射实验;
(2)硅为14号元素,其基态硅原子的价电子排布式为3s23p2 ;原子核外有多少个电子就有多少种运动状态;
(3)根据分子晶体熔沸点的比较进行解答;根据SiCl4遇水强烈水解写出反应方程式;
(4)根据原子半径越小,键长越短,则键能越大,则分子越稳定进行分析;
(5)每个Si原子周围距离相等且最近的C原子的个数即是Si原子的配位数;先计算晶胞的质量,再计算晶胞的边长,再根据距离最近的Si原子与C原子之间的距离为体对角线的![]() ,计算最近距离。
,计算最近距离。
(1)硅单质有晶体硅和无定形硅两种,区别晶体硅和无定形硅的科学方法是X—射线衍射实验;
故答案为:X—射线衍射实验;
(2)硅为14号元素,其基态硅的价电子排布式为3s23p2 ;其核外电子的运动状态有14种;
故答案为:3s23p2 ;14;
(3)CCl4和SiCl4常温下均呈液态,SiCl4熔沸点较高的原因为CCl4和SiCl4均为分子晶体,SiCl4相对分子质量大,范德华力大,熔沸点高;SiCl4遇水强烈水解,则SiCl4水解的化学方程式为SiCl4 + 3H2O == H2SiO3 + 4HCl;
故答案为:CCl4和SiCl4均为分子晶体,SiCl4相对分子质量大,范德华力大,熔沸点高;SiCl4 + 3H2O == H2SiO3 + 4HCl;
(4)SiF4的热稳定性比SiCl4强是因为F原子半径比Cl原子半径小,SiF4键能比SiCl4的键能大,则SiF4的热稳定性比SiCl4强;
故答案为:F原子半径比Cl原子半径小,SiF4键能比SiCl4的键能大,则SiF4的热稳定性比SiCl4强;
(5)根据晶胞结构图可知每个Si原子周围有4个C原子,则Si原子的配位数为4;晶体的密度为ρg/cm3![]() ,阿伏伽德罗常数为NA,每个晶胞中有4个Si原子,4个C原子,则晶胞的质量为
,阿伏伽德罗常数为NA,每个晶胞中有4个Si原子,4个C原子,则晶胞的质量为![]() ,则晶胞的边长为
,则晶胞的边长为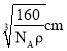 ,距离最近的Si原子与C原子之间的距离为体对角线的
,距离最近的Si原子与C原子之间的距离为体对角线的![]() ,则距离最近的Si原子与C原子之间的距离为
,则距离最近的Si原子与C原子之间的距离为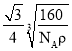 cm;
cm;
故答案为:4;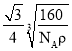 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某试剂瓶上贴有如下标签,对该试剂理解正确的是
![]()
A. 该溶液中含有的微粒主要有:NaCl、Na+、Cl-、H2O
B. 若取50毫升溶液,其中的c(Cl-)=0.05 mol/L
C. 若取该溶液与0.1 mol/L AgNO3 100 mL溶液完全反应,需要取该溶液10 mL
D. 该溶液与1.0mol/LNa2SO4溶液的c(Na+)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3 mol A和2.5 mol B混合于2 L密闭容器中,发生的反应如下:3A(g)+B(g) ![]() xC(g)+2D(g),5 min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.1 mol/(L·min),下列结论正确的是
xC(g)+2D(g),5 min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.1 mol/(L·min),下列结论正确的是
A. A的平均反应速率为 0.1 mol/(L·min)
B. 平衡时,C的浓度为 0.125 mol/L
C. 平衡时,B的转化率为 20%
D. 平衡时,容器内压强为原来的 0.8 倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解1.0 L c(Cl-)=3.0 mol/L的CuCl2、NaCl混合溶液,一段时间后,两极均收集到56.0 L的气体(标准状况下)。下列说法正确的是( )
A.阳极只收集到Cl2
B.电解前溶液呈弱酸性,电解结束后,溶液的酸性增强
C.整个过程中共转移电子5 mol
D.原混合溶液中c(Cu2+)=1.0 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车等机动车尾气,含(CO、NO等)是城市空气的污染源。利用NSR技术可有效降低CO、NO的排放,回答有关问题:
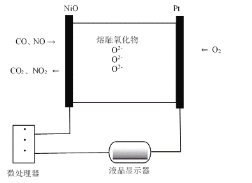
I.CO、NO的检测
(1)O2-的移动方向为__________。(填“向Pt电极”或“向NiO电极”)
(2)NiO电极上的电极反应为___________和__________。
II.NSR处理技术
NO的储存和还原在不同时段交替进行,实现两种有害气体,同时被处理,工作如图所示。
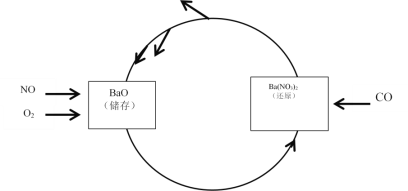
(3)已知:N2(g)+O2(g)=2NO(g) ΔH=+180.5 kJ/mol ①
2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ/mol ②
则NSR技术工作原理的热化学方程式:2CO(g)+2NO(g)=N2(g)+2CO2(g)③的ΔH=________
(4)在一定温度下,向2L恒容密闭容器中充入等物质的量的NO和CO,发生反应,反应过程中c(NO)随时间的变化曲线如图所示。
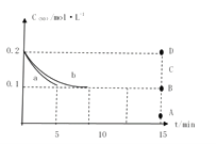
①图中曲线a或b中表示在该温度下使用NSR催化技术的是__________。
②曲线b中前10min内CO的平均反应速率v(CO)=_________;此温度下该反应的平衡常数K为_______。若平衡后,再向容器中充入CO和N2各0.8mol,则此时v(正)_____ v(逆)(填“>”、“<”或“=”)。
③若保持其他条件不变,15min时将容器的体积压缩至1L,20min时反应重新达到平衡,NO的物质的量浓度对应的点可能是____点。(填字母)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度和压强下,在2 L的密闭容器中合成氨气:N2(g)+3H2(g)![]() 2NH3(g) 。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。下列说法错误的是:
2NH3(g) 。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。下列说法错误的是:
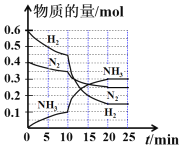
A. 0~10 min内,以NH3表示的平均反应速率为0.005 mol L-1 min-1
B. 10~20 min内,NH3浓度变化的原因可能是加入催化剂或缩小容器体积
C. 该反应在20 min时达到化学平衡状态
D. N2的平衡转化率与H2平衡转化率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaBiO3可作为钢铁分析中测定锰的氧化剂,Bi2O3在电子行业有着广泛应用,可利用浮选过的辉铋矿(主要成分是Bi2S3,还含少量SiO2等杂质)来制备。其工艺流程如下:
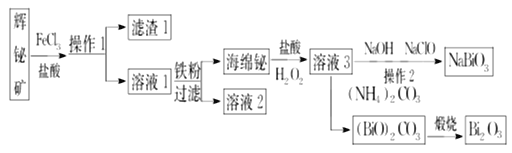
回答下列问题:
(1)辉铋矿的“浸出液”中铋元素主要以Bi3+形式存在,写出Bi2S3与FeCl3溶液反应的离子方程式:______,滤渣1的主要成分是__________(填化学式)和硫。
(2)NaBiO3是为数不多的钠盐沉淀之一,由溶液3制得纯净的NaBiO3,操作2包括_____________。
(3)Bi2O3与Na2O2可在熔融状态下反应制得NaBiO3,其副产物的化学式为________________。
(4)写出“煅烧”中由碱式碳酸铋[(BiO)2CO3]制备Bi2O3的化学方程式: ____________。
(5)某工厂用m1 kg辉铋矿(含Bi2S3 60%)制备NaBiO3,最终得到产品m2 kg,产率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有BaCl2和KCl的混合溶液VL,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀,消耗amolH2SO4;另一份滴加AgNO3溶液,消耗bmolAgNO3使Cl-完全沉淀。原混合溶液中的K+的物质的量浓度为____mol·L-1。
(2)一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则与1molCr3+反应所需PbO2的物质的量为____mol;
(3)在一定条件下,实验室分别以过氧化氢、高锰酸钾、氯酸钾、过氧化钠为原料制取氧气,当制得同温同压下相同体积的氧气时,四个反应中转移的电子数之比为_____。
(4)自来水中的NO3-对人类健康产生危害。为了降低自来水中NO3-的浓度,某研究人员提出在碱性条件下用Al粉还原NO3-,产物是N2。发生的反应可表示如下,请完成方程式的配平:
___Al+___NO3-+___—___AlO2-+___N2↑+___H2O
(5)某化学反应的反应物和产物:KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O
①该反应的氧化产物是____。
②若该反应方程式中I2和KIO3的计量数分别是6和3,则生成1molI2时,转移电子的物质的量为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,0.1 mol![]() 溶于水,转移的电子数目为0.1
溶于水,转移的电子数目为0.1![]()
B.标准状况下,2.24 L氧气与2.3 g金属钠充分反应,转移的电子数为0.4![]()
C.64 g 铜粉与足量硫粉混合加热充分反应,转移电子数为![]()
D.18 g![]() 含有10
含有10![]() 个中子
个中子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com