
【题目】NaBiO3可作为钢铁分析中测定锰的氧化剂,Bi2O3在电子行业有着广泛应用,可利用浮选过的辉铋矿(主要成分是Bi2S3,还含少量SiO2等杂质)来制备。其工艺流程如下:
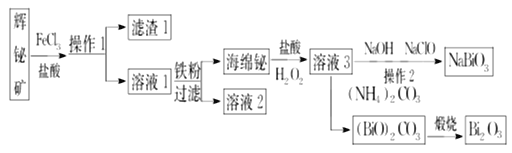
回答下列问题:
(1)辉铋矿的“浸出液”中铋元素主要以Bi3+形式存在,写出Bi2S3与FeCl3溶液反应的离子方程式:______,滤渣1的主要成分是__________(填化学式)和硫。
(2)NaBiO3是为数不多的钠盐沉淀之一,由溶液3制得纯净的NaBiO3,操作2包括_____________。
(3)Bi2O3与Na2O2可在熔融状态下反应制得NaBiO3,其副产物的化学式为________________。
(4)写出“煅烧”中由碱式碳酸铋[(BiO)2CO3]制备Bi2O3的化学方程式: ____________。
(5)某工厂用m1 kg辉铋矿(含Bi2S3 60%)制备NaBiO3,最终得到产品m2 kg,产率为__________。
【答案】Bi2S3+6Fe3+=2Bi3++6Fe2++3S SiO2 过滤、洗涤、干燥 Na2O (BiO)2CO3![]() Bi2O3+CO2↑
Bi2O3+CO2↑ ![]() ×100%
×100%
【解析】
利用浮选过的辉铋矿(主要成分是Bi2S3,还含少量SiO2等杂质)制备NaBiO3、Bi2O3流程:辉铋矿加入氯化铁、盐酸发生反应Bi2S3+6Fe3+=2Bi3++6Fe2++3S,杂质SiO2不反应,过滤得到滤液1和滤渣1(S和SiO2);滤液1中加入铁粉置换铋得到海绵铋;海绵铋中加入盐酸和过氧化氢发生氧化还原反应2Bi+6HCl+3H2O2=2BiCl3+6H2O,生成的溶液3为BiCl3溶液;BiCl3溶液中加入氢氧化钠和次氯酸钠可制备NaBiO3,若加入碳酸铵会生成(BiO)2CO3,煅烧(BiO)2CO3得到Bi2O3,据此解答。
(1)辉铋矿的“浸出液”中铋元素主要以Bi3+形式存在,Bi2S3与FeCl3溶液反应生成Bi3+、Fe2+和S,该反应的离子方程式为:Bi2S3+6Fe3+=2Bi3++6Fe2++3S;Bi3+易水解,加入盐酸既可提高铋的浸出率,又可抑制溶液中Bi3+的水解;滤渣1的主要成分是不溶于水的硫和SiO2;
(2)NaBiO3是为数不多的钠盐沉淀之一,通过反应Bi3++ClO-+4OH-+Na+=NaBiO3↓+Cl-+2H2O获得NaBiO3,想要获得纯净NaBiO3,首先要将NaBiO3沉淀过滤出来,再进行洗涤、干燥才可以得到纯净的NaBiO3,所以操作2包括:过滤、洗涤、干燥;
(3)Bi2O3与Na2O2可在熔融状态下反应制得NaBiO3,结合化合价变化情况可知,Na2O2被还原生成副产物Na2O;
(4)“煅烧”碱式碳酸铋[(BiO)2CO3]制备Bi2O3的化学方程式为:(BiO)2CO3![]() Bi2O3+CO2↑;
Bi2O3+CO2↑;
(5)某工厂用m1 kg 辉铋矿(含Bi2S360%)制备NaBiO3,最终得到产品m2kg为实际量,结合铋元素守恒计算,理论上应得到NaBiO3的质量为:![]() =
=![]() kg,所以其产率为:
kg,所以其产率为: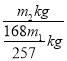 ×100%=
×100%=![]() ×100%。
×100%。


科目:高中化学 来源: 题型:
【题目】以乙醇为原料,用下述6种类型的反应:①氧化,②消去,③加成,④酯化,⑤水解,⑥加聚,来合成乙二酸乙二酯(![]() )的正确顺序是( )
)的正确顺序是( )
A. ①⑤②③④B. ①②③④⑤
C. ②③⑤①⑥D. ②③⑤①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L的密闭容器中,发生以下反应:2A(g)+B(g) ![]() 2C(g)+D(g),若最初加入的A和B都是4 mol,在前10 s A的平均反应速率为0.12 mol/(L·s),则10 s时,容器中B的物质的量是( )
2C(g)+D(g),若最初加入的A和B都是4 mol,在前10 s A的平均反应速率为0.12 mol/(L·s),则10 s时,容器中B的物质的量是( )
A.3.4 molB.3.2 molC.2.8 molD.1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅及其化合物在材料领域中应用广泛。回答下列问题:
(1)硅单质有晶体硅和无定形硅两种,区别晶体硅和无定形硅的科学方法是___________
(2)基态硅的价电子排布式为_________,其核外电子的运动状态有_____种。
(3)CCl4和SiCl4常温下均呈液态,SiCl4熔沸点较高的原因为________CCl4不水解,但SiCl4遇水即强烈水解,则SiCl4水解的化学方程式为__________。
(4)SiF4的热稳定性比SiCl4强的原因是 ____。
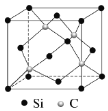
(5)碳化硅(SiC)的结构与金刚石类似,碳化硅的硬度仅次于金刚石,其晶胞结构如图所示。则Si原子的配位数为_______,若晶体的密度为ρg/cm3![]() ,阿伏伽德罗常数为NA,则距离最近的Si原子与C原子之间的距离为_______________cm。(用ρ和NA的式子表示)
,阿伏伽德罗常数为NA,则距离最近的Si原子与C原子之间的距离为_______________cm。(用ρ和NA的式子表示) ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表中的一部分,表中列出了11种元素在周期表中的位置,按要求完成下列各小题。
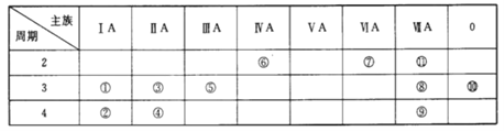
I. (1)化学性质最不活泼的元素是_____(填元素符号,下同),非金属性最强的元素是_____。金属性最强的单质与水反应的离子方程式是________。
(2)①③⑤三种元素的最高价氧化物对应的水化物中,碱性最强的化合物的化学式是____。
(3)①②③三种元素的原子半径由大到小的顺序是____>____>_____。
(4)某元素的最高价氧化物对应的水化物既能与酸反应生成盐和水又能和碱反应生成盐和水,该元素为_____。在这两种盐中该元素的化合价为_____,该元素的最高价氧化物和盐酸反应的离子方程式为_______。向该元素和⑧号元素形成的化合物的溶液中,缓慢滴加氢氧化钠溶液至过量,产生的实验现象是_______,有关反应的化学方程式为_______。
II.下列物质:①N2②CO2③NH3④Na2O⑤Na2O2⑥ NaOH ⑦CaBr2⑧H2O2 ⑨NH4Cl⑩Ar
(1)既含有极性键又含有非极性键的是_______;(填序号,下同)
(2)含有非极性键的离子化合物是___________
(3)不含化学键的是___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行有关铜、硝酸、硫酸化学性质的实验,实验过程如图所示:
实验1 | 实验2 |
|
|
①、③中溶液呈蓝色,试管口有红棕色气体产生 | ③中溶液呈蓝色,试管口有红棕色气体产生 |
下列说法正确的是
A. 稀硝酸一定被还原为NO2
B. 实验1-②中溶液存在:c(Cu2+) + c(H+) =c(NO3-) + c(OH-)
C. 由上述实验得出结论:常温下,Cu既可与稀硝酸反应,也可与稀硫酸反应
D. 实验1-③、实验2-③中反应的离子方程式:3Cu+2NO3-+8H+ =3Cu2++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究Na2O2与水的反应,实验如图:(已知:H2O2 ![]() H+ + HO2-、HO2-
H+ + HO2-、HO2- ![]() H+ + O22-)下列分析不正确的是
H+ + O22-)下列分析不正确的是

A. ①、⑤中产生的气体能使带火星的木条复燃
B. ①、④中均发生了氧化还原反应和复分解反应
C. ②、⑤中KMnO4与MnO2的作用不同,产生气体的量也不同
D. 通过③能比较酸性:HCl>H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述正确的是
A. 按上述流程,试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①过滤后所得沉淀为氧化铁
C. 图中所有的转化反应都不是氧化还原反应
D. 反应②的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G七种物质的转化关系如图所示(部分反应物、产物和反应条件未标出)。其中,A、B为中学化学常见的金属单质,C是淡黄色固体,D既能与强酸溶液反应,又能与强碱溶液反应,F溶液中加入AgNO3溶液产生不溶于稀硝酸的白色沉淀,E和G焰色反应均呈黄色。①、④均为燃烧反应。
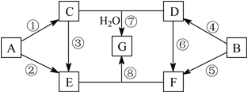
请回答下列问题:
(1)D的化学式____________,G的化学式____________。
(2)按要求写出下列反应的方程式:
③的化学方程式:___________________,
B与E的溶液反应的离子方程式:________________。
(3)将E的溶液逐滴加入到F的溶液中至过量,其现象是_____,总反应的离子方程式为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com