
【题目】探究Na2O2与水的反应,实验如图:(已知:H2O2 ![]() H+ + HO2-、HO2-
H+ + HO2-、HO2- ![]() H+ + O22-)下列分析不正确的是
H+ + O22-)下列分析不正确的是
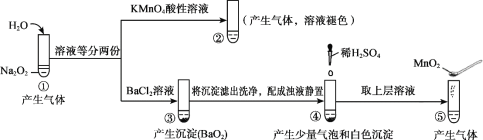
A. ①、⑤中产生的气体能使带火星的木条复燃
B. ①、④中均发生了氧化还原反应和复分解反应
C. ②、⑤中KMnO4与MnO2的作用不同,产生气体的量也不同
D. 通过③能比较酸性:HCl>H2O2
【答案】D
【解析】
根据实验探究可以看出,试管①过氧化钠与水反应生成氢氧化钠与氧气,试管②中高锰酸钾具有氧化性,产生气体,溶液褪色,则体现了过氧化氢的还原性;试管③中过氧化氢与氯化钡发复分解反应生成过氧化钡沉淀与稀盐酸,试管④中过氧化钡再与稀硫酸反应生成过氧化氢与硫酸钡沉淀,试管⑤中探究过氧化氢在二氧化锰催化剂作用下分解生成水和氧气,据此分析作答。
A. 试管①中过氧化钠与水反应最终生成氢氧化钠与氧气,试管⑤中过氧化氢在二氧化锰催化剂作用下分解生成水和氧气,因此产生的气体均能是带火星的木条复燃,A项正确;
B. ①中的反应机理可以认为过氧化钠与水反应生成过氧化氢与氢氧化钠,过氧化氢分解生成水和氧气,发生的反应为复分解与氧化还原反应,④中过氧化钡再与稀硫酸反应生成过氧化氢与硫酸钡沉淀,过氧化氢分解产生了氧气,因此两个试管中均发生了氧化还原反应和复分解反应,B项正确;
C. ②中KMnO4与过氧化氢反应生成氧气,KMnO4体现氧化性,而⑤中MnO2则起催化作用,两个试管中产生氧气的量均由过氧化氢的量决定,因溶液是等分的,所以产生气体的量相同,C项正确;
D. 根据已知条件可以看出过氧化氢属于二元弱酸,而盐酸属于一元强酸。试管③因为生成了过氧化钡沉淀,不是可溶性的盐溶液,则不能证明盐酸与过氧化氢的酸性强弱,D项错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】(1)0.3mol NH3中含有质子数与_________g H2O分子中所含质子数相等。
(2)100mL Al2(SO4)3溶液中c(SO42-)=0.9 mol/L,则n[Al2(SO4)3]=_____________。
(3)10mL 6 mol/L稀硫酸加水稀释到200mL,稀释后c(H+)=__________。
(4)已知某饱和NaCl溶液的体积为VmL。密度为ρg/cm3,质量分数为w。物质的量浓度为C mol/L,溶液中含NaCl的质量为m g.
①用m、V表示溶液物质的量浓度__________;
②用w、ρ表示溶液物质的量浓度__________;
③用w表示该温度下NaCl的溶解度________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为_____________
(2)W与Y 可形成化合物W2Y,该化合物的电子式为________________________。
(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为_________________________。Y的最高价氧化物是否满足8电子稳定结构______________(填是.否)
(4)比较Y、Z气态氢化物的稳定性由大到小的顺序是________________(用分子式表示)。
(5)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是
____________________________________________________。(用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚酰亚胺是重要的特种工程材料,广泛应用在航空、纳米、激光等领域。某聚酰亚胺的合成路线如下(部分反应条件略去):

已知:
①有机物A的质谱与核磁共振氢谱图如下:

②
③
回答下列问题:
(1)A的名称是__________________;C中含氧官能团的名称是________________。
(2)反应②的反应类型是____________________。
(3)反应①的化学方程式是__________________________。
(4) F的结构筒式是_____________________。
(5)同时满足下列条件的G的同分异构体共有___________种(不含立体结构);写出其中一种的结构简
式:________________。
①能发生银镜反应 ②能发生水解反应,其水解产物之一能与FeC13溶液发生显色反应
③1 mol该物质最多能与8 mol NaOH反应
(6) 参照上述合成路线,以间二甲苯和甲醇为原料(无机试剂任选)设计制备 的合成路线:_______________________。
的合成路线:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成都需要用它。
(1)工业上通常采用电解法制氯气,请观察图后回答下列问题:

① 请写出该反应的化学方程式________________________________。
② 通电后,b侧产生的气体是______![]() 填化学式
填化学式![]() 。
。
(2)某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉![]() 这是一个放热反应
这是一个放热反应![]() ,回答下列问题:
,回答下列问题:

①在A装置中用固体二氧化锰与浓盐酸,在加热条件下制取氯气,请写出反应的化学方程式________________________________。
②漂白粉将在U形管中产生,其化学方程式是______________________________。
③装置C的作用是______________。
④此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应:
I.温度较高时氯气与消石灰反应生成![]() ,为避免此副反应的发生,可采取的措施是________________________。
,为避免此副反应的发生,可采取的措施是________________________。
II.试判断另一个副反应![]() 用化学方程式表示
用化学方程式表示![]() ______________________________,为避免此副反应的发生,可以在A与B之间连接一个装有______的洗气瓶。
______________________________,为避免此副反应的发生,可以在A与B之间连接一个装有______的洗气瓶。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氧化还原反应的叙述正确的是( )
A.氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原
B.某金属元素M由化合态变为游离态,M一定被还原
C.用双线桥表示下列反应的电子转移
D.非金属单质在反应中只能作氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A,B,C,D,E五种元素,其中A,B,C,D为短周期元素,A元素的周期数、主族数、原子序数相同;B原子核外有3种能量不同的原子轨道且每种轨道中的电子数相同;C原子的价电子构型为csccpc+1,D元素的原子最外层电子数比次外层电子数少2个,D的阴离子与E的阳离子电子层结构相同,D和E可形成化合物E2D。
回答下列问题:
(1) C原子的价电子构型为csccpc+1 ,其中c为________, C原子的名称为__________ ;
(2)上述元素中,第一电离能最小的元素的原子结构示意图为__________________;
D的价电子排布图为______________________;E2D的电子式为__________________;
(3) 下列分子结构图中的●和○表示上述元素的原子中除去最外层电子的剩余部分,小黑点表示没有形成共价键的最外层电子,短线表示共价键.
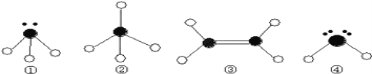
则在以上分子中,中心原子采用sp3杂化形成化学键的是___________(填写分子的化学式);
②分子中的键角是_____________; 在③的分子中有_______个σ键和_______个π键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】迄今为止我国相关部门已经发布了113号Nh、115号Mc、116号Lv、117号Ts、118号Og等元素的中文名称分别是:![]() ,下列有关推断正确的是
,下列有关推断正确的是
A. 这五种元素均为主族元素
B. 根据该名称,周期表118种元素中非金属元素共有24种
C. Nh的最高价氧化物是一种典型的两性氧化物
D. Ts的简单阴离子比该族上一周期简单阴离子的还原性弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 所含共价键数均为0.4NA的白磷(P4)和甲烷的物质的量相等
B. 1 mol Na与O2反应,生成Na2O和Na2O2的混合物共失去NA个电子
C. 1mol Na2O2固体中含有离子总数为4NA
D. 25℃时,pH=13的氢氧化钠溶液中约含有NA个氢氧根离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com