
【题目】下列有关氧化还原反应的叙述正确的是( )
A.氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原
B.某金属元素M由化合态变为游离态,M一定被还原
C.用双线桥表示下列反应的电子转移
D.非金属单质在反应中只能作氧化剂
科目:高中化学 来源: 题型:
【题目】对如图所示有机物分子的叙述错误的是( )
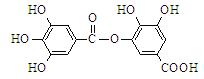
A. 碱性条件下能发生水解,1 mol该有机物完全反应消耗8 mol NaOH
B. 常温下,能与Na2CO3溶液反应放出CO2
C. 与稀硫酸共热,能生成两种有机物
D. 该有机物遇FeCl3溶液显色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一反应体系中有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。 已知该反应中H2O2只发生如下过程:H2O2→O2
(1)该反应中的还原剂是______________。(填化学式)
(2)该反应中,发生还原反应的过程是________→________。(填化学式)
(3)写出该反应的化学方程式,并用单线桥标出电子转移的方向和数目:____________________________________________________________。
(4)如反应转移了0.3 mol电子,则产生的气体在标准状况下体积为__________。
(5)反应8NH3+3Cl2=6NH4Cl+N2中,氧化剂与还原剂的物质的量之比是_________。
(6)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式:______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. AB3型的分子空间构型必为平面三角形
B. PCl3分子是三角锥形,这是因为磷原子是sp2杂化的结果
C. sp3杂化轨道是由任意的1个s轨道和3个p轨道混合形成的4个sp3杂化轨道
D. 中心原子采取sp3杂化的分子,其几何构型可能是四面体形或三角锥形或V形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究Na2O2与水的反应,实验如图:(已知:H2O2 ![]() H+ + HO2-、HO2-
H+ + HO2-、HO2- ![]() H+ + O22-)下列分析不正确的是
H+ + O22-)下列分析不正确的是

A. ①、⑤中产生的气体能使带火星的木条复燃
B. ①、④中均发生了氧化还原反应和复分解反应
C. ②、⑤中KMnO4与MnO2的作用不同,产生气体的量也不同
D. 通过③能比较酸性:HCl>H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1) 碳、氮、氧三元素的第一电离能由小到大的顺序为______________(用元素符号及“ < ”表示);碳、氮、氧三元素的电负性由小到大的顺序为_____________(用元素符号及“ < ”表示)。
(2) N3-的立体构型是___________形;与N3-互为等电子体的一种分子是___________(填分子式)。
(3)在元素周期表中铍和铝被称为“对角线规则”,请写出铍的氧化物和氢氧化物分别与氢氧化钠溶液反应的离子方程式___________________ ,______________________ 。
(4)将足量的氨水逐滴地加入到CuSO4溶液中,先生成沉淀,然后沉淀溶解生成配合物[Cu(NH3)4]SO4,配位化合物中的阳离子结构式为___________;用价层电子对互斥理论解释SO42-的键角大于SO32-的原因是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 1mol 铁和高温水蒸气完全反应转移的电子数为3NA
B. 常温常压下,1mol 氦气含有的原子数为NA
C. 标准状况下,11. 2 L 乙醇含有的分子数目为0. 5NA
D. 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 个数为 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲溶液可能含有K+、Ca2+、NH4+、Cu2+、NO3-、Cl-、SO42-、CO32-八种离子中的若干种![]() 为确定甲溶液的组成,将其分成两等份,进行如下实验:
为确定甲溶液的组成,将其分成两等份,进行如下实验:
①向一份溶液中加入足量的NaOH浓溶液并加热,产生的气体在标准状况下体积为4.48L。
②向另一份溶液中加入0.6 mol/L的BaCl2溶液500mL,恰好可以与溶液中的离子完全反应,过滤得66.3g沉淀及滤液。
③向上述沉淀中加入过量的盐酸,产生的气体通入足量澄清的石灰水中,得到一定量的沉淀X。
④向上述滤液中加入1 mol/L AgNO3溶液650 mL,恰好可完全反应,据此,请回答下列问题![]() 用相应的离子符号表示
用相应的离子符号表示![]() :
:
⑴上述实验③中得到沉淀X的质量为______;生成沉淀X的离子方程式为______.
⑵甲溶液中一定不存在的离子是______;可能存在的离子是______.
⑶甲溶液一定存在的离子中,物质的量最大的离子是______;物质的量最小的离子是______,此物质的量最小的离子其物质的量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以柏林绿Fe[Fe(CN)6]为代表的新型可充电钠离子电池,其放电工作原理如图所示。下列说法正确的是

A. 放电时,Mo箔上的电势比Mg箔上的低
B. 充电时,Mo箔接电源的负极
C. 放电时,正极反应为Fe[Fe(CN)6]+2Na++2e-=Na2Fe[Fe(CN)6]
D. 充电时,外电路中通过0.2mol电子时,阴极质量增加3.55g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com