
【题目】回答下列问题:
(1) 碳、氮、氧三元素的第一电离能由小到大的顺序为______________(用元素符号及“ < ”表示);碳、氮、氧三元素的电负性由小到大的顺序为_____________(用元素符号及“ < ”表示)。
(2) N3-的立体构型是___________形;与N3-互为等电子体的一种分子是___________(填分子式)。
(3)在元素周期表中铍和铝被称为“对角线规则”,请写出铍的氧化物和氢氧化物分别与氢氧化钠溶液反应的离子方程式___________________ ,______________________ 。
(4)将足量的氨水逐滴地加入到CuSO4溶液中,先生成沉淀,然后沉淀溶解生成配合物[Cu(NH3)4]SO4,配位化合物中的阳离子结构式为___________;用价层电子对互斥理论解释SO42-的键角大于SO32-的原因是_________________________________。
【答案】C<O<N C< N < O 直线 N2O或CO2或BeCl2 BeO+2OH- ===BeO2- + H2O Be(OH) 2 +2OH- ===BeO22- +2 H2O 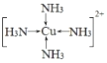 两种离子的中心硫原子均为sp3杂化, SO42-中没有孤对电子,SO32-有一对孤对电子,孤电子对对成键电子有挤压作用,因此键角更小
两种离子的中心硫原子均为sp3杂化, SO42-中没有孤对电子,SO32-有一对孤对电子,孤电子对对成键电子有挤压作用,因此键角更小
【解析】
(1) 同周期自左而右,第一电离能呈增大趋势,但氮元素的2p能级为半满稳定状态,能量低,第一电离能高于同周期相邻元素第一电离能,所以第一电离能氮>氧>碳,同周期元素从左向右,电负性逐渐增大,则碳、氮、氧三元素的电负性由小到大的顺序为:C<N<O,
故答案为:C<O<N,C< N < O;
(2) N3-含有三个原子22个电子,与其等电子体的分子有N2O或CO2或CS2或BeCl2,N3-与CO2是等电子体,具有相同的价电子数,它们具有相似的结构,二氧化碳是直线型分子,所以N3-的空间构型是直线形.
故答案为:直线;N2O或CO2或CS2或BeCl2;
(3)在元素周期表中铍和铝被称为“对角线规则”,金属铍与铝的单质及其化合物性质相似,则BeO与NaOH溶液反应生成Na2BeO2和水,离子反应为BeO+2OH- ===BeO2- + H2O,Be(OH)2与NaOH溶液反应生成Na2BeO2和水,离子反应方程式为:Be(OH) 2 +2OH- ===BeO22- +2 H2O,
故答案为:BeO+2OH- ===BeO2- + H2O;Be(OH) 2 +2OH- ===BeO22- +2H2O;
(4)生成的配合物[Cu(NH3)4]SO4中的阳离子为:[Cu(NH3)4]2+,其中N原子和铜原子之间存在配位键,阳离子结构式为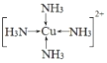 ,SO42-的价层电子对数=4+
,SO42-的价层电子对数=4+![]() (6-2×4+2)=4,即SO42-的中心原子S是sp3杂化,不含有孤电子对,SO32-的价层电子对数=3+
(6-2×4+2)=4,即SO42-的中心原子S是sp3杂化,不含有孤电子对,SO32-的价层电子对数=3+![]() (6-2×3+2)=4,即SO32-的中心原子S是sp3杂化,且含有1个孤电子对,孤电子对对成键电子有挤压作用,因此键角更小,
(6-2×3+2)=4,即SO32-的中心原子S是sp3杂化,且含有1个孤电子对,孤电子对对成键电子有挤压作用,因此键角更小,
故答案为:两种离子的中心硫原子均为sp3杂化, SO42-中没有孤对电子,SO32-有一对孤对电子,孤电子对对成键电子有挤压作用,因此键角更小。


科目:高中化学 来源: 题型:
【题目】化合物乙是一种治疗神经类疾病的药物,可由化合物甲经多步反应得到。下列有关甲、乙的说法不正确的是
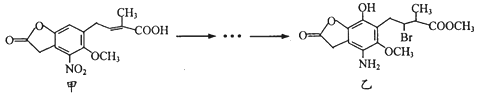
A. 甲的分子式为C14H11NO7
B. 甲和乙所含官能团均为5种
C. 可用NaHCO3溶液鉴别化合物甲和乙
D. 甲能与酸性高锰酸钾溶液反应,乙能与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.某物质不是电解质就是非电解质
B.碳酸氢钠在水中的电离方程式:![]()
C.能电离出H+ 的化合物都是酸
D.导电性强的溶液里自由移动的离子数目不一定比导电性弱的溶液里自由移动的离子数多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氧化还原反应的叙述正确的是( )
A.氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原
B.某金属元素M由化合态变为游离态,M一定被还原
C.用双线桥表示下列反应的电子转移
D.非金属单质在反应中只能作氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)据科技日报网报道,南开大学科研团队借助镍和苯基硼酸共催化剂,首次实现烯丙醇高效、绿色合成。烯丙醇及其化合物可制成甘油、医药、农药、香料,合成维生素E和KI及天然抗癌药物紫杉醇中都含有关键的烯丙醇结构。丙烯醇的结构简式为CH2=CH-CH2OH。请回答下列问题:
①基态镍原子的价电子排布式为___________________。
②1 mol CH2=CH-CH2OH含____molσ键,烯丙醇分子中碳原子的杂化类型为________。
③ Ni2+能形成多种配离子,如[Ni(NH3)6]2+、[Ni(CN)2]2- 和[Ni(SCN)2]- 等,与CN-互为等电子体的分子为____________。
(2)乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
①CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为_____________; lmol O22+中含有的π键数目为_______________。
②将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为____________。
③乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是_______________;分子中处于同一直线上的原子数目最多为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】喝茶,对很多人来说是人生的一大快乐,茶叶中含有少量的咖啡因。咖啡因具有扩张血管、刺激心脑等作用,咖啡因是弱碱性化合物,易溶于氯仿、乙醇、丙酮及热苯等,微溶于水、石油醚。含有结晶水的咖啡因是无色针状结晶,味苦,在100℃时失去结晶水并开始升华,120℃时升华相当显著,178℃时升华很快。结构式如右,实验室可通过下列简单方法从茶叶中提取咖啡因:

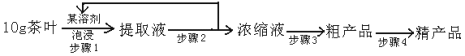
(1)咖啡因的分子式为________________。
(2)步骤1泡浸茶叶所用的溶剂最好为(_______)
A 水 B 酒精 C 石油醚
(3)咖啡因中含氧官能团的名称为______________
(4)1mol咖啡因催化加氢,最多能消耗_____________mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于Na2CO3和NaHCO3的说法正确的是 ( )
A.在水中的溶解性:NaHCO3>Na2CO3
B.与质量分数相同的盐酸溶液反应放出气体的快慢:NaHCO3<Na2CO3
C.热稳定性:NaHCO3<Na2CO3
D.等质量的固体与足量盐酸反应放出CO2的质量Na2CO3>NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.熔融NaCl能导电,是因为通电时NaCl发生了电离
B.NaCl固体不导电,因为NaCl固体中无带电微粒
C.NH4NO3电离时产生了NH![]() 、NO
、NO![]() ,无金属离子,所以NH4NO3不是盐
,无金属离子,所以NH4NO3不是盐
D.NaHSO4在水溶液中电离生成了Na+、H+、SO![]() 三种离子
三种离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com