
【题目】(1)据科技日报网报道,南开大学科研团队借助镍和苯基硼酸共催化剂,首次实现烯丙醇高效、绿色合成。烯丙醇及其化合物可制成甘油、医药、农药、香料,合成维生素E和KI及天然抗癌药物紫杉醇中都含有关键的烯丙醇结构。丙烯醇的结构简式为CH2=CH-CH2OH。请回答下列问题:
①基态镍原子的价电子排布式为___________________。
②1 mol CH2=CH-CH2OH含____molσ键,烯丙醇分子中碳原子的杂化类型为________。
③ Ni2+能形成多种配离子,如[Ni(NH3)6]2+、[Ni(CN)2]2- 和[Ni(SCN)2]- 等,与CN-互为等电子体的分子为____________。
(2)乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
①CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为_____________; lmol O22+中含有的π键数目为_______________。
②将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为____________。
③乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是_______________;分子中处于同一直线上的原子数目最多为_______________。
【答案】3d84s2 9 sp2、sp3 N2(或CO等合理答案) ![]() 2NA 1s22s22p63s23p63d10 sp sp2杂化 3
2NA 1s22s22p63s23p63d10 sp sp2杂化 3
【解析】
根据电子排布规律书写电子排布式;根据成键特点及等电子体概念判断中心原子轨道杂化类型;根据成键特点分析有机物的空间结构。
(1)①根据能量最低原理知基态镍原子的价电子排布式为3d84s2;
②单键是σ键,碳碳双键中含1个σ键和1个π键,所以1 mol CH2=CH-CH2OH含9molσ键,烯丙醇分子碳碳双键两端的碳原子轨道杂化类型与乙烯分中碳原子杂化类型相同,为sp2杂化,单键两端的碳原子与甲烷中碳原子轨道杂化类型相同,为sp3杂化,
③ 等电子体是指价电子数和原子数相同的分子、离子或原子团,则与CN-互为等电子体的分子为N2或CO,
故答案为:3d84s2;9;sp2、sp3 ;N2或CO
(2)①C22-与O22+互为等电子体,等电子体的化学键和构型类似,则O22+的电子式可表示为![]() ;氧氧三键中含1个σ键和2个π键,则lmol O22+中含有的π键数目为2NA;
;氧氧三键中含1个σ键和2个π键,则lmol O22+中含有的π键数目为2NA;
②根据核外电子排布规律得Cu+基态核外电子排布式为 1s22s22p63s23p63d10,
③形成双键的碳原子轨道杂化类型为sp2,形成三键的碳原子轨道杂化类型为sp;H2C=CH-C≡N分子中处于同一直线上的原子数目最多为C-C≡N三个原子,
故答案为: ![]() ;2NA;1s22s22p63s23p63d10;sp 、sp2杂化;3。
;2NA;1s22s22p63s23p63d10;sp 、sp2杂化;3。


科目:高中化学 来源: 题型:
【题目】(化学——选修5:有机化学基础)
芳香烃A可以合成扁桃酸,也可以合成H。以下是合成线路(部分产物、反应条件已略去):

已知:
I、
II、![]()
III、
IV、D的相对分子质量为137,且在苯环的对位上有两个取代基
V、E为一溴取代物
请回答下列问题:
(1)扁桃酸中含氧官能团的名称是 ________;物质B的结构简式 ________。
(2)上述①~⑥反应中属于取代反应的是 ________(填序号)。
(3)关于H物质,下列说法正确的是 ________ (填字母序号)。
A.所有碳原子可能处于同一平面
B.可以发生加成反应、聚合反应、氧化反应和还原反应
C.H与G都能与新制Cu(OH)2反应
(4)写出反应⑥的化学方程式 ________。
(5)X是扁桃酸的同分异构体,1 mol X可与2 mol Na2CO3反应,其核磁共振氢谱有四组峰,峰面积之比为3:2:2:1,其结构简式为 ________ (任写两种)。
(6)请结合所学知识和上述信息,写出由A和乙醛为原料(无机试剂任用)制备肉桂醛(![]() )的合成路线流程图 ________。
)的合成路线流程图 ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验是化学学习的重要内容。根据你掌握的知识,完成下面内容。
![]() 实验室需要配制0.1 mol·L-1NaOH溶液230mL,请回答下列问题:
实验室需要配制0.1 mol·L-1NaOH溶液230mL,请回答下列问题:
![]() 应选择____mL的容量瓶,用天平称取____g NaOH。
应选择____mL的容量瓶,用天平称取____g NaOH。
![]() 溶解NaOH后的溶液需冷却到室温后方能转移入容量瓶中。若趁热转移会使溶液的浓度______(填“偏大”或“偏小”,下同);在洗涤烧杯和玻璃棒的过程中,每次洗涤液均需注入容量瓶,不能损失点滴液体,否则会导致溶液的浓度______。
溶解NaOH后的溶液需冷却到室温后方能转移入容量瓶中。若趁热转移会使溶液的浓度______(填“偏大”或“偏小”,下同);在洗涤烧杯和玻璃棒的过程中,每次洗涤液均需注入容量瓶,不能损失点滴液体,否则会导致溶液的浓度______。
![]() 有人认为,用这种方法只能配置0.1 mol·L-1的NaOH溶液,而无法得到0.1000 mol·L-1的NaOH溶液,你觉得他的理由是__________________________________________。
有人认为,用这种方法只能配置0.1 mol·L-1的NaOH溶液,而无法得到0.1000 mol·L-1的NaOH溶液,你觉得他的理由是__________________________________________。
![]() 选择下列实验方法分离物质,将分离方法的序号填在横线上。
选择下列实验方法分离物质,将分离方法的序号填在横线上。
![]() 萃取分液
萃取分液 ![]() 升华
升华 ![]() 结晶
结晶 ![]() 过滤
过滤 ![]() 蒸馏
蒸馏 ![]() 分液
分液
![]() 分离饱和食盐水与沙子的混合物______;
分离饱和食盐水与沙子的混合物______;
![]() 从硝酸钾和氯化钠的混合液中获得硝酸钾______;
从硝酸钾和氯化钠的混合液中获得硝酸钾______;
![]() 从碘水中提取碘单质______;
从碘水中提取碘单质______;
![]() 分离水和汽油的混合物______;
分离水和汽油的混合物______;
![]() 分离
分离![]() 沸点为
沸点为![]() 和甲苯
和甲苯![]() 沸点为
沸点为![]() 的混合物______。
的混合物______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中,有关微粒物质的量浓度关系正确的是( )
A. 0.1mol·L-1(NH4)2Fe(SO4)2溶液:c(![]() )>c(
)>c(![]() )>c(H+)>c(Fe2+)
)>c(H+)>c(Fe2+)
B. 将100mL 0.1mol·L-1Na2CO3溶液逐滴滴加到100mL 0.1mol·L-1盐酸中:c(Na+)>c(C1-)>c(![]() )>c(
)>c(![]() )
)
C. pH=12的NaOH溶液与等体积pH=2的醋酸溶液混合后:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D. 0.1mol·L-1NaHCO3溶液:c(H+)+2c(H2CO3)=c(OH-)+c(![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1) 碳、氮、氧三元素的第一电离能由小到大的顺序为______________(用元素符号及“ < ”表示);碳、氮、氧三元素的电负性由小到大的顺序为_____________(用元素符号及“ < ”表示)。
(2) N3-的立体构型是___________形;与N3-互为等电子体的一种分子是___________(填分子式)。
(3)在元素周期表中铍和铝被称为“对角线规则”,请写出铍的氧化物和氢氧化物分别与氢氧化钠溶液反应的离子方程式___________________ ,______________________ 。
(4)将足量的氨水逐滴地加入到CuSO4溶液中,先生成沉淀,然后沉淀溶解生成配合物[Cu(NH3)4]SO4,配位化合物中的阳离子结构式为___________;用价层电子对互斥理论解释SO42-的键角大于SO32-的原因是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1999年比利时发生奶粉受二噁英污染事件。二噁英是一类芳香族化合物的多氯代衍生物的总称,结构稳定,难以被自然分解,是公认的最危险的致癌物质之一,2,3,7,8-四氯二苯并二噁英是其中的一种,结构如图,下列说法中不正确的是 ( )
![]()
A. 它的分子式为C12H4O2Cl4B. 它不能发生加成反应
C. 它的一溴取代物有一种D. 此分子中共平面的原子最多有22个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性。当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓硫酸与乙醇的混合液体变为棕黑色。
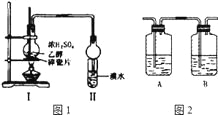
(1)写出该实验中生成乙烯的化学方程式: _______
(2)甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是 (填字母序号)
A.乙烯与溴水易发生取代反应 B.使溴水褪色的反应,未必是加成反应
C.使溴水褪色的物质,未必是乙烯 D.浓硫酸氧化乙醇生成乙醛,也会使溴水褪色
(3)乙同学经过细致观察后认为试管中另一现象可证明反应中有乙烯生成,这个现象是____________
(4)丙同学对上述实验装置进行了改进,在I和II之间增加如图2装置,则A中的试剂应为______________,其作用是______________,B中的试剂为______________
(5)处理上述实验后烧瓶中废液的正确方法是 (填字母序号)
A.废液冷却后倒入下水道中
B.废液冷却后倒入空废液缸中
C.将水加入烧瓶中稀释后倒入废液缸.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家用![]() Ca轰击
Ca轰击![]() Bk(锫)生成
Bk(锫)生成![]() Up和
Up和![]() Up,Up可能是科学家一直寻找的第117号元素。下列关于
Up,Up可能是科学家一直寻找的第117号元素。下列关于![]() Ca、
Ca、![]() Bk(锫)、
Bk(锫)、![]() Up和
Up和![]() Up说法中正确的是( )
Up说法中正确的是( )
A. 117号元素的相对原子质量为293.5
B. ![]() Up和
Up和![]() Up互为同位素
Up互为同位素
C. ![]() Ca、
Ca、![]() Bk(锫)、
Bk(锫)、![]() Up和
Up和![]() Up表示四种核素,属于四种元素
Up表示四种核素,属于四种元素
D. 该轰击表明通过化学反应可以合成新元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤及工业废气中的SO2是形成酸雨的主要原因,消除SO2是减少酸雨形成的有效方法。完成下列问题:
(1)已知:4FeS2(s)+11O2(g)═2Fe2O3(s)+8SO2(g)△H=﹣3412.0kJmol﹣1
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=﹣25.0 kJmol﹣1
2C(s)+O2(g)═2CO(g)△H=﹣221.0 kJmol﹣1
则2FeS2(s)+7O2(g)+3C(s)═2Fe(s)+3CO2(g)+4SO2(g)△H=_____kJmol﹣1。
(2)碱性NaClO2溶液脱硫法
SO2与碱性NaClO2溶液反应的离子方程式为2SO2+ClO2﹣+4OH﹣2SO42﹣+C1﹣+2H2O,已知pc=﹣lgc(SO2)。在刚性容器中,将含SO2的废气通入碱性NaClO2溶液中,测得pc与温度的关系如图所示。
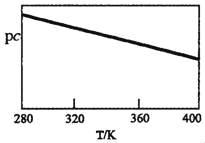
由图分析可知,该脱硫反应是_____反应(填“放热”或“吸热”);若温度不变,增大压强,该脱硫反应的平衡常数K_____(填“增大”、“减小”或“不变”)。
(3)燃料细菌脱硫法
①含FeS2的燃煤可用氧化亚铁硫杆菌(T.f)、氧化亚铁微螺菌(L.f)、氧化硫硫杆菌(T.t)进行脱硫,其脱硫过程如图所示:
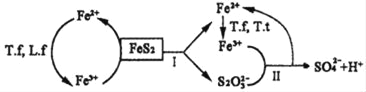
已知:脱硫总反应为:FeS2+14Fe3++8H2O═2SO42﹣+15Fe2++16H+,
Ⅰ反应的化学方程式为:FeS2+6Fe3++3H2O═S2O32﹣+7Fe2++6H+;
写出Ⅱ反应的化学方程式_____。
②在上述脱硫反应中,氧化亚铁硫杆菌(T.f)与Fe3+的形成过程可视为下图所示的原电池:

该细胞膜为_____(填“阳离子交换膜”或“阴离子交换膜”)。该电池的正极电极反应式为_____。该方法在高温下脱硫效率大大降低,原因是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com