
【题目】常温下,下列溶液中,有关微粒物质的量浓度关系正确的是( )
A. 0.1mol·L-1(NH4)2Fe(SO4)2溶液:c(![]() )>c(
)>c(![]() )>c(H+)>c(Fe2+)
)>c(H+)>c(Fe2+)
B. 将100mL 0.1mol·L-1Na2CO3溶液逐滴滴加到100mL 0.1mol·L-1盐酸中:c(Na+)>c(C1-)>c(![]() )>c(
)>c(![]() )
)
C. pH=12的NaOH溶液与等体积pH=2的醋酸溶液混合后:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D. 0.1mol·L-1NaHCO3溶液:c(H+)+2c(H2CO3)=c(OH-)+c(![]() )
)
【答案】C
【解析】
A. 0.1molL1(NH4)2Fe(SO4)2溶液中铵根离子、亚铁离子水解,溶液显酸性,离子浓度大小为: c(SO42)> c(NH4+)>c(Fe2+)>c(H+),故A错误;
B. 将100mL 0.1molL1Na2CO3溶液逐滴滴加到100mL 0.1molL1盐酸中,碳酸钠与过量盐酸反应生成氯化钠、二氧化碳气体和水,最终得到氯化钠和碳酸钠的混合物,钠离子、氯离子不水解,碳酸根离子部分水解,则离子浓度大小为:c(Na+)>c(Cl)>c(CO32)>c(HCO3),故B错误;
C. pH=12 NaOH溶液与等体积pH=2的醋酸混合后的溶液中,醋酸为弱酸又电离出醋酸根离子和氢离子,溶液显酸性,离子浓度大小为:c(CH3COO)>c(Na+)>c(H+)>c(OH),故C正确;
D. 0.1molL1NaHCO3溶液中电荷守恒式为:c(H+)+c(Na+)=c(OH)+2c(CO32)+c(HCO3),物料守恒式为:c(Na+)=c(CO32)+c(HCO3)+c(H2CO3),得到离子浓度关系c(H+)+c(H2CO3)=c(OH)+c(CO32),故D错误;
答案选C。


 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】化合物Z是合成平喘药沙丁胺醇的中间体,可通过下列路线制得:

下列说法正确的是( )
A. X分子中所有原子在同一平面上
B. Y与足量H2的加成产物分子中有2个手性碳原子
C. 可用FeCl3溶液鉴别Y和Z
D. 1 mol Z最多能与2 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年8月“非洲猪瘟”首次传入我国,已从最初的单点爆发演变为区域性爆发。(其病毒结构如图所示)疫情的爆发和蔓延对全国生猪市场产生了重大影响,今年5月份以来各地猪肉价格飞涨。中国科学家们正在努力研制疫苗,以帮助保护全世界的猪肉供应。9月10日,中国农业科学院院长、中国工程院院士唐华俊在中国农业科学院非洲猪瘟防控与生猪复养技术推介会上介绍,我国非洲猪瘟疫苗研制在今年4月实验室研究工作取得成功后,疫苗研发工作又取得了新的重要进展。我国非洲猪瘟疫苗将进入临床试验阶段。下列有关说法中错误的是( )
A. 疫苗一般应冷藏存放,以避免蛋白质变性
B. 非洲猪瘟迅速在全国蔓延,有可能通过空气传播
C. 非洲猪瘟病毒DNA分子内存在氢键,氢键是一种共价键
D. 非洲猪瘟病毒,可以通过高温方式进行杀灭
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含+6价铬的污水会污染环境,电镀厂产生的镀铜废水中往往含有一定量的![]() ,处理该废水常用还原沉淀法,具体流程如下:
,处理该废水常用还原沉淀法,具体流程如下:

(1)步骤①用稀硫酸调节pH,不选用盐酸的原因是______________________________。
(2)已知每消耗1mol Na2S2O3转移8mol e-,则加入Na2S2O3溶液时发生反应的离子方程式为:_________________________________________________________。
(3)已知Cr(OH)3的化学性质与Al(OH)3相似。步骤②加入NaOH溶液时要控制溶液的pH不能过高,是因为___________________________________________(用离子方程式表示)。
(4)下列溶液中可以代替上述流程中Na2S2O3溶液最佳的是__________(填选项序号);
A.FeSO4溶液 B.浓H2SO4C.Na2SO3溶液 D.酸性KMnO4溶液
(5)某厂废水中含1.50×10-3mol/L的![]() ,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Cr的化合价为+3,Fe的化合价依次为+3、+2)可变废为宝。欲使1 L该废水中的
,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Cr的化合价为+3,Fe的化合价依次为+3、+2)可变废为宝。欲使1 L该废水中的![]() 完全转化为Cr0.5Fe1.5FeO4,理论上需要加入__________gFeSO4·7H2O。(已知FeSO4·7H2O的摩尔质量为278g/mol)
完全转化为Cr0.5Fe1.5FeO4,理论上需要加入__________gFeSO4·7H2O。(已知FeSO4·7H2O的摩尔质量为278g/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.某物质不是电解质就是非电解质
B.碳酸氢钠在水中的电离方程式:![]()
C.能电离出H+ 的化合物都是酸
D.导电性强的溶液里自由移动的离子数目不一定比导电性弱的溶液里自由移动的离子数多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按顺序填写下列分子或离子中中心原子的孤电子对数,杂化轨道类型,立体构型名称。
(1)HCN__________、__________、__________;
(2)NH2-__________、__________、__________;
(3)NO2+_________、 __________、 __________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)据科技日报网报道,南开大学科研团队借助镍和苯基硼酸共催化剂,首次实现烯丙醇高效、绿色合成。烯丙醇及其化合物可制成甘油、医药、农药、香料,合成维生素E和KI及天然抗癌药物紫杉醇中都含有关键的烯丙醇结构。丙烯醇的结构简式为CH2=CH-CH2OH。请回答下列问题:
①基态镍原子的价电子排布式为___________________。
②1 mol CH2=CH-CH2OH含____molσ键,烯丙醇分子中碳原子的杂化类型为________。
③ Ni2+能形成多种配离子,如[Ni(NH3)6]2+、[Ni(CN)2]2- 和[Ni(SCN)2]- 等,与CN-互为等电子体的分子为____________。
(2)乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
①CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为_____________; lmol O22+中含有的π键数目为_______________。
②将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为____________。
③乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是_______________;分子中处于同一直线上的原子数目最多为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77 kJmol-1
CH3OH(g) △H3=-90.77 kJmol-1
回答下列问题:
(1)反应Ⅱ的△H2=_________,若反应Ⅰ、Ⅱ、Ⅲ平衡常数分别为K1、K2、K3,则K2=________(用K1、K3表示)。
(2)反应Ⅲ自发进行条件是___________(填“较低温度”、“较高温度”或“任何温度”)。
(3)在一定条件下2 L恒容密闭容器中充入3 mol H2和1.5 mol CO2,仅发生反应Ⅰ,实验测得不同反应温度与体系中CO2的平衡转化率的关系,如下表所示。
温度(℃) | 500 | T |
CO2的平衡转化率 | 60℅ | 40℅ |
①T______500℃(填“>”、“<” 、“=”)。
②温度为500℃时,该反应10 min时达到平衡。用H2表示该反应的反应速率v(H2)=______________;该温度下,反应I的平衡常数K=______________L2/mol2
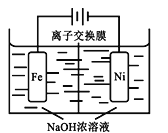
(4)由CO2制备甲醇还需要氢气。工业上用电解法制取Na2FeO4,同时获得氢气:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图所示。电解一段时间后,c(OH)降低的区域在__________ (填“阴极室”或“阳极室”)。该室发生的电极反应式为:___________________________。
FeO42+3H2↑,工作原理如图所示。电解一段时间后,c(OH)降低的区域在__________ (填“阴极室”或“阳极室”)。该室发生的电极反应式为:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:
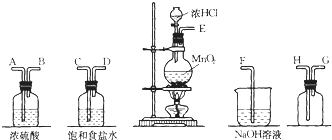
(1)连接上述仪器的正确顺序是:E接__,__接__,__接__,__接F。
(2)气体发生装置中进行的反应化学方程式是__;当0.5molMnO2参与反应时,生成的Cl2在标准状况下的体积约__。
(3)在装置中:①饱和食盐水的作用是__,②浓硫酸的作用是___。
(4)化学实验中检验是否有Cl2产生常用湿润的淀粉-KI试纸。如果有Cl2产生,可观察到的现象是___。
(5)写出尾气吸收装置中进行的反应的化学方程式__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com