
【题目】按顺序填写下列分子或离子中中心原子的孤电子对数,杂化轨道类型,立体构型名称。
(1)HCN__________、__________、__________;
(2)NH2-__________、__________、__________;
(3)NO2+_________、 __________、 __________;
【答案】0 sp 直线形 2 sp3 V形 0 sp 直线形
【解析】
根据价层电子对互斥理论分析解答;根据中心原子杂化类型与微粒的立体构型的关系分析解答。
(1) HCN的中心原子的孤对电子对数=![]() (4-1×3-1×1)=0,即不含有孤对电子对,HCN的中心原子的价层电子对数=2+
(4-1×3-1×1)=0,即不含有孤对电子对,HCN的中心原子的价层电子对数=2+![]() (4-3×1-1×1)=2,即中心原子C是sp杂化,HCN形成了直线形结构,
(4-3×1-1×1)=2,即中心原子C是sp杂化,HCN形成了直线形结构,
故答案为:0;sp;直线形;
(2) NH2-的中心原子的孤对电子对数=![]() (5-1×2+1)=2,即含有2对孤对电子对,NH2-的中心原子的价层电子对数=2+
(5-1×2+1)=2,即含有2对孤对电子对,NH2-的中心原子的价层电子对数=2+![]() (5-1×2+1)=4,即NH2-中N原子是sp3,且含有2对孤对电子对,立体构型为V形;
(5-1×2+1)=4,即NH2-中N原子是sp3,且含有2对孤对电子对,立体构型为V形;
故答案为:2;sp3;V形;
(3) NO2+的中心原子的孤对电子对数=![]() (5-2×2-1)=0,即不含有孤对电子对,NO2+中心原子的价层电子对数=2+
(5-2×2-1)=0,即不含有孤对电子对,NO2+中心原子的价层电子对数=2+![]() (5-2×2-1)=2,中心原子N原子是sp杂化,即NO2+的立体构型是直线形结构;
(5-2×2-1)=2,中心原子N原子是sp杂化,即NO2+的立体构型是直线形结构;
故答案为:0;sp;直线形。


科目:高中化学 来源: 题型:
【题目】氯化铅(PbCl2)常用于焊接和制备铅黄等染料。利用从废旧铅蓄电池中得到的铅膏获取氯化铅的流程如图,试回答下列问题:

已知:①铅膏主要由PbSO4、PbO、PbO2和Pb等组成。
②流程图中的“1”表示液体,“s”表示固体。
③硫酸铅、氯化铅微溶于水,但氯化铅能溶于NaCl溶液中,主要发生反应:PbCl2+Cl-==[PbCl3]-。
(1)铅蓄电池的正极材料是________________(填化学式),放电时负极的电极反应式为________。
(2)“浸取反应”是在加热条件下,用盐酸和氯化钠溶液浸取铅膏的过程,主要发生反应的方程式有PbP
PbO2+Pb+4HCl==2PbCl2+2H2O PbO+2HCl==PbCl2+H2O,
PbSO4+2NaCl==PbCl2+Na2SO4 PbCl2+Cl-=[PbCl3]-
除此之外,PbO2还能与HCl反应产生一种黄绿色气体,该反应的化学方程式是________________;该浸取过程中Pb与盐酸反应产生的H2可能会与________ (填气体名称,下同)、________等混合发生爆炸。
(3)PbCl2(溶液显酸性)在氯化钠溶液中的溶解度随温度的升高而增大,适当地升高温度有利于提高铅的浸取率,当温度高于70℃时,浸取率提高不明显,可能的原因是________________________________;为了提高浸取率,还可以采取的措施是________________________________________。
(4)在室温下静置冷却3h后,过滤得到的氯化铅的回收率可达到85%,过滤后得到的滤液进行循环使用可提高铅的利用率。在循环使用之前需加入氯化钙将SO42-进行沉淀转化,若无此步骤,直接循环使用,溶液中SO42-浓度过大,则会导致的结果是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组在实验室用下图所示装置快速制取氨并验证氨的某些性质,同时收集少量纯净的氮气,请回答。
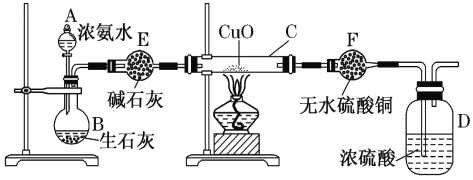
(1)写出用生石灰和浓氨水反应制氨的化学方程式____________________________,解释放出NH3的原因_______________________________________________________。
(2)实验进行一段时间,观察到硬质玻璃管内黑色氧化铜粉末变为红色,盛无水硫酸铜的干燥管内出现蓝色,并且在最后的出气导管口处收集到纯净、干燥的氮气。根据这些现象,写出在硬质玻璃管内发生反应的化学方程式:___________________________________,
(3)在最后的出气导管口处收集干燥、纯净的氮气,收集方法是________。
A.排空气法 B.排水法 C.用气囊收集
(4) E中的碱石灰________(填“能”或“不能”)换成CaCl2。
(5) 在浓硝酸中放入铜片,若铜有剩余,开始反应的化学方程式为 __________________,
(6) 若将12.8 g铜跟一定量的浓硝酸反应,铜消耗完时,共产生NO和NO2 气体V L(标准状况),将产生的气体与一定量的氧气混合恰好被一定量的NaOH溶液吸收生成硝酸盐,则通入氧气的物质的量是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. NH3和CH4的中心原子都是sp3杂化
B. 基态原子的核外电子排布为[Kr]4d105s1的元素属于d区
C. SO2和CO2都是直线形分子,其中心原子都是sp杂化
D. 电子由低能级跃迁至较高能级时,可通过光谱仪直接摄取原子的发射光谱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中,有关微粒物质的量浓度关系正确的是( )
A. 0.1mol·L-1(NH4)2Fe(SO4)2溶液:c(![]() )>c(
)>c(![]() )>c(H+)>c(Fe2+)
)>c(H+)>c(Fe2+)
B. 将100mL 0.1mol·L-1Na2CO3溶液逐滴滴加到100mL 0.1mol·L-1盐酸中:c(Na+)>c(C1-)>c(![]() )>c(
)>c(![]() )
)
C. pH=12的NaOH溶液与等体积pH=2的醋酸溶液混合后:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D. 0.1mol·L-1NaHCO3溶液:c(H+)+2c(H2CO3)=c(OH-)+c(![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是“国际化学元素周期表年”。下列有关说法不正确的是
A. 制冷剂氟里昂-12(CCl2F2)的研发利用,充分体现了元素周期表的指导作用
B. 通过测定物质中![]() 的含量可以推断文物的年代
的含量可以推断文物的年代
C. 门捷列夫预言的“类铝” 镓(Ga)元素的发现,证实了元素周期律的科学性
D. 过渡元素Ti、Mo、W等的单质有耐高温,耐腐蚀的特点,其合金可以制造火箭、导弹、宇宙飞船等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1999年比利时发生奶粉受二噁英污染事件。二噁英是一类芳香族化合物的多氯代衍生物的总称,结构稳定,难以被自然分解,是公认的最危险的致癌物质之一,2,3,7,8-四氯二苯并二噁英是其中的一种,结构如图,下列说法中不正确的是 ( )
![]()
A. 它的分子式为C12H4O2Cl4B. 它不能发生加成反应
C. 它的一溴取代物有一种D. 此分子中共平面的原子最多有22个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、Na+、Fe3+、Mg2+、Al3+等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸时,发现生成沉淀的物质的量随盐酸溶液的体积变化的图像如图所示,下列说法正确的是
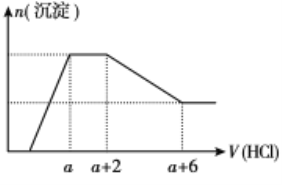
A. 原溶液中一定含有Na2SO4
B. 反应后最终溶液中的溶质只有AlCl3
C. 原溶液中含有CO32-与AlO2-的物质的量之比为1:1
D. 原溶液中一定含有的阴离子是OH-、SiO32-、AlO2-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列相关化学用语表述正确的是( )
A. NH4Cl的电子式: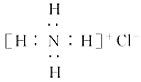
B. C原子的轨道表示式: ![]()
C. 冰醋酸为共价化合物,受热熔融:CH3COOH![]() CH3COO-+H+
CH3COO-+H+
D. Fe2+基态核外电子排布式为1s22s22p63s23p63d6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com