
【题目】2019年是“国际化学元素周期表年”。下列有关说法不正确的是
A. 制冷剂氟里昂-12(CCl2F2)的研发利用,充分体现了元素周期表的指导作用
B. 通过测定物质中![]() 的含量可以推断文物的年代
的含量可以推断文物的年代
C. 门捷列夫预言的“类铝” 镓(Ga)元素的发现,证实了元素周期律的科学性
D. 过渡元素Ti、Mo、W等的单质有耐高温,耐腐蚀的特点,其合金可以制造火箭、导弹、宇宙飞船等
【答案】B
【解析】
A. 制冷剂是一种易被压缩、液化的气体,蒸发时吸收热量,使环境温度降低,达到制冷目的.人们曾采用过乙醚、氨、氯甲烷等制冷剂,但它们或者有毒,或者易燃,科学家根据元素及其化合物性质的递变规律来研制了新的制冷剂氟里昂-12(CCl2F2),充分体现了元素周期表的指导作用,故A正确;
B. 考古学家通过测定古生物遗骸中的碳-14含量来推断文物年代,不是![]() ,故B错误;
,故B错误;
C. 门捷列夫在研究周期表时预言了包括“类铝”、“类硅”在内的11种元素,“类铝” 镓(Ga)元素的发现,证实了元素周期律的科学性,故C正确;
D. 根据元素周期表的应用,过渡元素Ti、Mo、W等的单质有耐高温,耐腐蚀的特点,单质及其合金可以用于制造火箭、导弹、宇宙飞船等,故D正确;
答案选B。


科目:高中化学 来源: 题型:
【题目】Zn在现代工业中对于电池制造上有不可磨灭的地位,明朝末年宋应星所著的《天工开物》一书中就有世界上最早的关于炼锌技术的记载。回答下列问题:
(1)Zn基态原子的电子排布式为___________,4s能级上的成对电子数为___________。
(2)葡萄糖酸锌{[CH2OH( CHOH)4COO]2Zn}是目前市场上流行的补锌剂。葡萄糖酸锌中碳原子杂化形式有___________,C、H两元素的第一电离能的大小关系为___________________。
(3)ZnCl2与NH3形成的配合物[Zn(NH3)4]Cl2中,存在___________(填字母)。
A离子键 B.σ键 C.π键
(4)锌与某非金属元素X形成的化合物晶胞如图所示,其中Zn和X通过共价键结合,该化合物中Zn与X的原子个数之比为___________。
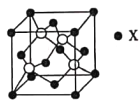
(5)在图示晶胞中若只考查X的排列方式,则X的堆积方式属于金属晶体堆积方式中的___________堆积;设阿伏加德罗常数的数值为NA,该晶胞中Zn的半径为r1nm,X的半径为r2nm,X的相对原子质量为M,则该晶体的密度为___________g·cm-3(用含r1、r2、M、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修3:物质结构与性质】我国科学家借助自主研制的新型钨钴合金催化剂攻克了单壁碳纳米管结构的可控制备难题。
(1)基态钴原子的核外电子排布式为 。单壁碳纳米管可看作石墨烯沿一定方向卷曲而成的空心圆柱体,其碳原子的杂化方式为 。
(2)纳米结构氧化钴可在室温下将甲醛(HCHO)完全催化氧化,已知甲醛各原子均满足稳定结构,甲醛分子属 分子(选填“极性”“非极性”),其立体构型为 。
(3)橙红色晶体羰基钴[Co2(CO)8]的熔点为52℃,可溶于多数有机溶剂。该晶体属于 晶体,三种元素电负性由大到小的顺序为(填元素符号) 。配体CO中σ键与π键数之比是 。

(4)元素铁、钴、镍并称铁系元素,性质具有相似性。某含镍化合物结构如上图所示,分子内的作用力不可能含有 (填序号)。
A离子键 B共价键 C金属键 D配位键 E氢键
(5)钨为熔点最高的金属,硬度极大,其晶胞结构如图所示,已知钨的密度为ρ g·cm-3,则每个钨原子的半径r= cm。(只需列出计算式)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】准确书写离子方程式是学好化学的基本素养之一,下列离子方程式书写正确的是( )
A.氢氧化镁与稀硫酸反应:![]()
B.用饱和氯化铁溶液制取氢氧化铁胶体:![]()
C.石灰乳与碳酸钠溶液反应:![]()
D.向NaHSO4溶液中滴加Ba(OH)2溶液至刚好沉淀完全:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按顺序填写下列分子或离子中中心原子的孤电子对数,杂化轨道类型,立体构型名称。
(1)HCN__________、__________、__________;
(2)NH2-__________、__________、__________;
(3)NO2+_________、 __________、 __________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G、W是原子序数依次增大的8种元素,A元素原子的2p原子轨道上有 2个未成对的电子,B元素在同周期中原子半径最大,与A可形成原子个数比为1 : 1和2 : 1的两种化合物,C单质是一种常见的半导体材料,F有 9个原子轨道,G的单质是一种常见金属,W能形成红色(或砖红色)的W2A和黑色的WA两种氧化物。
(1)A元素在元素周期表中的位置是__________;写出B元素与A形成原子个数比为1 : 1的化合物的电子式____________________________ ;
(2)写出C基态时的价电子排布式:_______________________;
(3)D、E、F三者第一电离能从大到小的顺序是__________(用元素符号及“ > ”表示)。
(4)G位于元素周期表的位置是_________________, G3+比G2+稳定,原因是____________;
(5)W能形成红色(或砖红色)的W2A, W2A的化学式为_______________ ,W在周期表的_____ 区。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用下列装置进行乙醇催化氧化的实验。
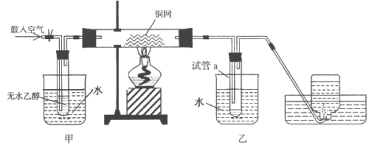
(1)实验过程中铜网出现红色和黑色交替的现象,请写出铜网由黑变红的化学方程式:________;在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是_____ 反应。
(2)甲和乙两个水浴作用不相同。甲的作用是_______________;乙的作用是_________________。
(3)反应进行一段时间后,干燥试管a中能 收集到不同的物质,它们是_____。集气瓶中收集到的气体的主要成分是 ________________。
(4)试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有____________ 。要除去该物质,可在混合液中加入______(填写字母),然后再通过___________(填实验操作名称)即可除去。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D的原子序数依次增大。X、Y、Z、W分别是由这四种元素中的两种组成的常见化合物,Y为淡黄色固体,W为常见液体;甲为单质,乙为红棕色气体;上述物质之间的转化关系如图所示(部分生成物已省略)。则下列说法中不正确的是
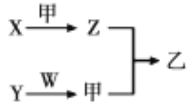
A. 沸点:W>X
B. 原子半径:D>B>C>A
C. C、D两种元素组成的化合物只含有离子键
D. A、B、C三种元素组成的化合物既可以是离子化合物,又可以是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.氧化铜与稀盐酸混合:CuO+2H+=Cu2++H2O
B.稀硫酸与氢氧化钡溶液混合:SO![]() +Ba2+=BaSO4↓
+Ba2+=BaSO4↓
C.用醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O
D.向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO![]() +OH
+OH![]() =CaCO3↓+H2O
=CaCO3↓+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com