
【题目】Zn在现代工业中对于电池制造上有不可磨灭的地位,明朝末年宋应星所著的《天工开物》一书中就有世界上最早的关于炼锌技术的记载。回答下列问题:
(1)Zn基态原子的电子排布式为___________,4s能级上的成对电子数为___________。
(2)葡萄糖酸锌{[CH2OH( CHOH)4COO]2Zn}是目前市场上流行的补锌剂。葡萄糖酸锌中碳原子杂化形式有___________,C、H两元素的第一电离能的大小关系为___________________。
(3)ZnCl2与NH3形成的配合物[Zn(NH3)4]Cl2中,存在___________(填字母)。
A离子键 B.σ键 C.π键
(4)锌与某非金属元素X形成的化合物晶胞如图所示,其中Zn和X通过共价键结合,该化合物中Zn与X的原子个数之比为___________。
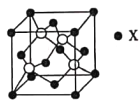
(5)在图示晶胞中若只考查X的排列方式,则X的堆积方式属于金属晶体堆积方式中的___________堆积;设阿伏加德罗常数的数值为NA,该晶胞中Zn的半径为r1nm,X的半径为r2nm,X的相对原子质量为M,则该晶体的密度为___________g·cm-3(用含r1、r2、M、NA的代数式表示)。
【答案】1s22s22p63s23p63d104s2或[Ar] 3d104s2 2 sp2、sp3 C<H AB 1:1 面心立方最密 ![]()
【解析】
(1)Zn原子核外电子数为30,其核外电子排布式为:1s22s22p63s23p63d104s2或[Ar] 3d104s2;
4s能级上只有2个电子且成对,故成对电子数为2;
(2)葡萄糖酸锌里有两种碳原子,一种是以sp3杂化(接羟基的碳),一种是以sp2杂化(—COO-里的碳);
第一电离能表示气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,由于H的电子层数少、原子半径最小,原子核对外层电子的引力较强,故第一电离能C<H;
(3) 配合物[Zn(NH3)4]Cl2中[Zn(NH3)4]2+与氯离子形成离子键,Zn2+与NH3之间形成σ键, NH3中氮原子与氢原子之间形成σ键,答案选AB;
(4)根据均摊法计算,晶胞中锌的个数为4个,X的个数为8×![]() +6×
+6×![]() =4,该化合物中Zn与X的原子个数之比为1:1;
=4,该化合物中Zn与X的原子个数之比为1:1;
(5)根据晶胞结构特点可知,X的堆积方式属于金属晶体堆积方式中的面心立方最密堆积;设晶胞得边长是a,则根据晶胞结构可知![]() a=(4r1+4r2)nm,解得a=
a=(4r1+4r2)nm,解得a=![]() nm,则根据
nm,则根据![]() ×NA=4,解得ρ=
×NA=4,解得ρ=![]() g·cm-3。
g·cm-3。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生如下反应:2N2O5(g) ![]() 4NO2(g)+O2(g) ΔH>0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
4NO2(g)+O2(g) ΔH>0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
时间/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)/ mol·L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法正确的是
A. 500 s内NO2的生成速率为2.96×10-3 mol·L-1·s-1
B. T1温度下该反应平衡时NO2的产率为25%
C. 达到平衡后,其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)<5.00 mol·L-1
D. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下为中学化学中常见的物质:①Cu; ②1molL﹣1的FeCl3溶液; ③CuCl2溶液;④CO2;⑤H2SO4;⑥酒精;⑦CaCO3;⑧FeSO4;⑨Ba(OH)2
(1)以上物质中属于电解质的是__;属于非电解质的是__.
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入②的溶液,至液体呈透明的红褐色氢氧化铁胶体.则反应的化学方程式为__________________;
(3)将②③⑧混合配制成浓度均为1molL﹣1的混合溶液100mL,加入一定量的铁粉,充分反应后,若铁粉无剩余,且有铜生成.则反应后的溶液中一定含有__阳离子,可能含有__阳离子.
(4)向⑨溶液中逐滴加入稀硫酸,请完成下列问题:
① 写出该反应的离子方程式:______________________________.
② 下列三种情况下,离子方程式与①相同的是__( 填序号).
A.向NaHSO4 溶液中逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4 溶液中逐滴加入Ba(OH)2溶液至SO42﹣恰好完全沉淀
C.向NaHSO4 溶液中逐滴加入Ba(OH)2溶液至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某市售“84消毒液”瓶体部分标签如下图所示,该“84 消毒液”通常稀释100 倍(体积之比)后使用.请回答下列问题:

(1)该“84 消毒液”的物质的量浓度约为__mol/L.( 保留小数点后 1 位)
(2)该同学参阅此“84 消毒液”的配方,欲用NaClO固体配制480mL 与市售物质的量浓度相同的“84 消毒液”,下列说法中正确的是__( 填序号).
A.如下图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0g

(3)“84 消毒液”与稀硫酸混合使用可增强其消毒能力,某消毒小组人员用 98%( 密度为1.84g/cm3)的浓硫酸配制 500mL 2.3mol/L 的稀硫酸用于增强“84 消毒液”的消毒能力.
①需用浓硫酸的体积为__mL.
②取用任意体积的浓硫酸时,下列物理量中不随所取体积的多少而变化的是__。
A.溶液中H2SO4的物质的量 B.溶液的浓度
C.溶液的质量 D.溶液的密度
③对浓硫酸稀释过程中遇到下列情况,使所配制的硫酸浓度大于2.3mol/L有__。
A.未经冷却趁热将溶液注入容量瓶中
B.摇匀后发现液面低于刻度线,再加水至刻度线
C.容量瓶中原有少量蒸馏水
D.定容时俯视观察液面.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA(s)+bB(g) ![]() cC(g)+dD(g);△H=QkJ/mol,在反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如下图所示:则以下正确的是
cC(g)+dD(g);△H=QkJ/mol,在反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如下图所示:则以下正确的是

A. T1>T2,Q>0
B. T2>T1,Q>0
C. P1<P2,a+b=c+d
D. P1<P2,b=c+d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【题目】已知:①H2(g)+ ![]() O2(g)=2H2O(g) △H1=akJ/mol
O2(g)=2H2O(g) △H1=akJ/mol
②2H2(g)+O2(g)=2H2O(g) △H2=b kJ/mol
③H2(g)+ ![]() O2(g)=H2O(l) △H3=ckJ/mol;
O2(g)=H2O(l) △H3=ckJ/mol;
④2H2(g)+O2(g)=2H2O(l) △H4=dkJ/mol。
下列关系正确的是
A. a<c<0 B. b>d>0 C. 2a=b<0 D. 2c=d>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,在一烧杯中盛有100mLH2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央。向该烧杯里缓缓注入Ba(OH)2溶液至恰好完全反应,在此过程中:

(1)烧杯里观察到的实验现象有:
① _______________________________________
② _______________________________________
(2)写出实验过程中反应的离子方程式:_______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知苯乙烯的结构为![]() 。有关该物质的下列说法正确的是( )
。有关该物质的下列说法正确的是( )
A. 该物质在一定条件下和氢气完全加成,加成产物的一溴取代物 6 种
B. 该物质能使溴水和酸性高锰酸钾溶液褪色,褪色原理完全相同
C. 苯乙烯分子的所有原子不可能在同一平面上
D. 除去乙苯中混有的苯乙烯可以通入等量氢气反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com