
【题目】已知苯乙烯的结构为![]() 。有关该物质的下列说法正确的是( )
。有关该物质的下列说法正确的是( )
A. 该物质在一定条件下和氢气完全加成,加成产物的一溴取代物 6 种
B. 该物质能使溴水和酸性高锰酸钾溶液褪色,褪色原理完全相同
C. 苯乙烯分子的所有原子不可能在同一平面上
D. 除去乙苯中混有的苯乙烯可以通入等量氢气反应
【答案】A
【解析】
A.在一定条件下和氢气完全加成,生成乙基环己烷,含6种H;
B.碳碳双键与溴水发生加成反应,与高锰酸钾发生氧化反应;
C.苯环及碳碳双键均为平面结构,且直接相连;
D.苯环可与氢气发生加成反应。
A.在一定条件下和氢气完全加成,生成乙基环己烷,含6种H,则加成产物的一溴取代物有6种,所以A选项是正确的;
B.碳碳双键与溴水发生加成反应,与高锰酸钾发生氧化反应,均褪色,但原理不同,故B错误;
C.苯环及碳碳双键均为平面结构,且直接相连,则苯乙烯分子的所有原子可能在同一平面上,故C错误;
D.苯环和碳碳双键均可与氢气发生加成反应,该反应为可逆反应,无法控制反应的限度,无法除杂,故D错误。
所以A选项是正确的。


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
【题目】向溶质为FeBr2、FeI2的溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,结果溶液变为血红色,则下列叙述不正确的是 ( )
A. 原溶液中的Br-不一定被氧化
B. 通入氯气之后原溶液中的Fe2+一定被氧化
C. 不能确定通入氯气之后的溶液中是否存在Fe2+
D. 若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgNO3溶液,能产生黄色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸的反应为S+2KNO3+3C![]() K2S+N2↑+3CO2↑,下列说法中正确的是 ( )
K2S+N2↑+3CO2↑,下列说法中正确的是 ( )
A. 该反应中的还原剂为KNO3
B. 该反应中C被还原
C. 若消耗32g S,该反应转移电子数为2 NA
D. 若生成标准状况下气体22.4L,则有0.75 mol物质被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:

(1)该“84消毒液”的物质的量浓度约为_________mol·L-1(保留2位有效数字)
(2)某同学取100 mL 该“84消毒液”,按规定标准稀释后用于消毒,稀释后的溶液中:c(Na+)=__________mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数为25%的消毒液。下列说法正确的是__________(填字母)。
A.如下图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器

B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0g
(4)如上面第(3)小题A选项所示,除了应该使用的仪器外,还需要的玻璃仪器是______________。
(5)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用18.4 mol·L-1的浓硫酸配制2000 mL 2.3 mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为__________mol·L-1。
②需用浓硫酸的体积为__________mL。
(6)测定“84消毒液”中次氯酸钠含量的主要步骤:
a.取5.00mL“84消毒液”经稀释等步骤最后定容于250mL容量瓶中;
b.取稀释后的溶液25.00mL于锥形瓶中,加入足量硫酸酸化的KI溶液,在阴凉处静置5分钟;
c.加入5~10滴0.5%的淀粉溶液,溶液变蓝色,再用c mol·L-1Na2S2O3溶液滴定,当消耗的Na2S2O3溶液为VmL时,溶液的蓝色恰好退去,且半分钟内蓝色不再恢复。则“84消毒液”中NaClO的浓度为__________g·L-1。(用c、V表示)
(已知:2KI + H2SO4 + NaClO = I2 + K2SO4 + NaCl + H2O;I2 + 2Na2S2O3 = 2NaI + Na2S4O6)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示一些物质间的从属关系,不正确的是( )
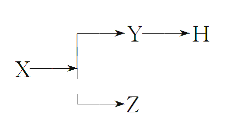
选项 | X | Y | Z | H |
A | 分散系 | 胶体 | 溶液 | 烟 |
B | 电解质 | 酸 | 碱 | 盐 |
C | 元素周期表的纵行 | 主族 | 副族 | 卤族 |
D | 化合物 | 共价化合物 | 离子化合物 | 酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组设计了如下装置对焦炭还原二氧化硅气体产物的成分进行探究。
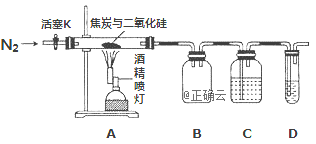
已知:PdCl2溶液可用于检验CO,反应的化学方程式为: CO+PdCl2 + H2O = CO2 +2HCl + Pd↓(产生黑色金属钯粉末,使溶液变浑浊)。
(1)实验时要通入足够长时间的N2,其原因是________
(2)装置B的作用是________
(3)装置C中所盛试剂应为___________
(4)该装置的缺点是________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M、R均为主族元素,已知M的一个原子失去2个电子,R的一个原子得到1个电子后形成稀有气体元素的电子层结构。下列关于M与R形成的化合物的叙述正确的是( )
A. M与R可以形成MR2型离子化合物
B. 在MR2中M的离子半径比R的离子半径大
C. 形成的两种离子分别是M+和R2-
D. MR2的电子式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:

已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
A. 550℃时,若充入惰性气体,正,逆 均减小,平衡不移动
B. 650℃时,反应达平衡后CO2的转化率为25.0%
C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500 mL有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀.则原混合溶液中钾离子物质的量浓度为( )
A. 0.1(b-2a)mol/L B. 10(2a-b)mol/L
C. 10(b-a)mol/L D. 10(b-2a)mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com