
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:

(1)该“84消毒液”的物质的量浓度约为_________mol·L-1(保留2位有效数字)
(2)某同学取100 mL 该“84消毒液”,按规定标准稀释后用于消毒,稀释后的溶液中:c(Na+)=__________mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数为25%的消毒液。下列说法正确的是__________(填字母)。
A.如下图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器

B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0g
(4)如上面第(3)小题A选项所示,除了应该使用的仪器外,还需要的玻璃仪器是______________。
(5)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用18.4 mol·L-1的浓硫酸配制2000 mL 2.3 mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为__________mol·L-1。
②需用浓硫酸的体积为__________mL。
(6)测定“84消毒液”中次氯酸钠含量的主要步骤:
a.取5.00mL“84消毒液”经稀释等步骤最后定容于250mL容量瓶中;
b.取稀释后的溶液25.00mL于锥形瓶中,加入足量硫酸酸化的KI溶液,在阴凉处静置5分钟;
c.加入5~10滴0.5%的淀粉溶液,溶液变蓝色,再用c mol·L-1Na2S2O3溶液滴定,当消耗的Na2S2O3溶液为VmL时,溶液的蓝色恰好退去,且半分钟内蓝色不再恢复。则“84消毒液”中NaClO的浓度为__________g·L-1。(用c、V表示)
(已知:2KI + H2SO4 + NaClO = I2 + K2SO4 + NaCl + H2O;I2 + 2Na2S2O3 = 2NaI + Na2S4O6)
【答案】3.99 0.0399 C 胶头滴管和玻璃棒4.6 25074.5![]()
【解析】
(1)根据c(NaClO)=![]() 计算该“84消毒液”的物质的量浓度;(2)根据稀释前后溶质物质的量不变计算稀释后c(NaClO);(3)配制一定物质的量浓度的溶液需用托盘天平称取次氯酸钠固体的质量、用烧杯和玻璃棒溶解次氯酸钠,用500mL容量瓶、胶头滴管定容;容量瓶不需要烘干后使用;未用蒸馏水洗涤烧杯和玻璃棒,使溶质减少,导致结果偏低;使用500mL容量瓶,所以次氯酸钠的质量是
计算该“84消毒液”的物质的量浓度;(2)根据稀释前后溶质物质的量不变计算稀释后c(NaClO);(3)配制一定物质的量浓度的溶液需用托盘天平称取次氯酸钠固体的质量、用烧杯和玻璃棒溶解次氯酸钠,用500mL容量瓶、胶头滴管定容;容量瓶不需要烘干后使用;未用蒸馏水洗涤烧杯和玻璃棒,使溶质减少,导致结果偏低;使用500mL容量瓶,所以次氯酸钠的质量是![]() ;(4)根据第(3)题的分析,需要的玻璃仪器是胶头滴管和玻璃棒;(5)①稀硫酸中,H+的物质的量浓度是硫酸浓度的2倍;②根据稀释前后溶质物质的量不变计算需用浓硫酸的体积;(6)根据2KI + H2SO4 + NaClO = I2 + K2SO4 + NaCl + H2O;I2 + 2Na2S2O3 = 2NaI + Na2S4O6,得关系式NaClO ~~I2~~ 2Na2S2O3,根据关系式计算NaClO的浓度;
;(4)根据第(3)题的分析,需要的玻璃仪器是胶头滴管和玻璃棒;(5)①稀硫酸中,H+的物质的量浓度是硫酸浓度的2倍;②根据稀释前后溶质物质的量不变计算需用浓硫酸的体积;(6)根据2KI + H2SO4 + NaClO = I2 + K2SO4 + NaCl + H2O;I2 + 2Na2S2O3 = 2NaI + Na2S4O6,得关系式NaClO ~~I2~~ 2Na2S2O3,根据关系式计算NaClO的浓度;
(1)c(NaClO)=![]() molL-1;
molL-1;
(2)稀释前后NaClO物质的量不变, ![]() ,稀释后c(NaClO)=0.0399 molL-1,c(Na+)= c(NaClO)=0.0399 molL-1;
,稀释后c(NaClO)=0.0399 molL-1,c(Na+)= c(NaClO)=0.0399 molL-1;
(3)配制一定物质的量浓度的溶液需用托盘天平称取次氯酸钠固体的质量、用烧杯和玻璃棒溶解次氯酸钠,用500mL容量瓶、胶头滴管定容,不需要烧瓶和分液漏斗,还需要胶头滴管和玻璃棒两种玻璃仪器,故A错误;容量瓶不需要烘干后使用,故B错误;未用蒸馏水洗涤烧杯和玻璃棒,使溶质减少,导致结果偏低,故C正确;需用500mL容量瓶,所以次氯酸钠的质量是![]() ,故D错误;
,故D错误;
(4)根据第(3)题的分析,需要的玻璃仪器是胶头滴管和玻璃棒;
(5)①稀硫酸中,H+的物质的量浓度是硫酸浓度的2倍,所以H+的物质的量浓度为4.6mol·L-1;②设需用浓硫酸的体积为VL,根据稀释前后硫酸的物质的量不变,2L× 2.3 mol·L-1=V×18.4 mol·L-1,V=0.25L=250mL;
(6)设NaClO的浓度为xmol·L-1
NaClO ~~ I2 ~~ 2 Na2S2O3
1 2
![]()
![]()
x=![]() mol·L-1。
mol·L-1。
所以NaClO的浓度是![]() mol·L-1
mol·L-1![]() =74.5
=74.5![]() g·L-1
g·L-1


科目:高中化学 来源: 题型:
【题目】钨(74W)是熔点最高的金属,是重要的战略物资。自然界中钨矿石的主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含少量Si、P、As的化合物。由黑钨矿冶炼钨的工艺流程如下:

已知:①滤渣I的主要成份是Fe2O3、MnO2。②上述流程中,除最后一步外,其余步骤钨的化合价未变。③常温下钨酸难溶于水。
回答下列问题:
(1)钨酸中钨元素的化合价为_________,写出MnWO4在熔融条件下发生碱分解反应生成MnO2的化学方程式___________________________________________。
(2)上述流程中向粗钨酸钠溶液中加硫酸调pH=10后,溶液中的杂质阴离子为SiO32-、HAsO32-、HAsO42-、HPO42-等,则“净化”过程中,加入H2O2时发生反应的离子方程式为_______________________________。
(3)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线。则T1________T2(填“>”或“<”)。
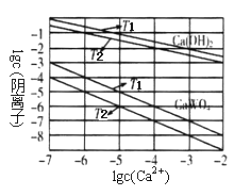
将钨酸钠溶液加入石灰乳得到大量钨酸钙,发生反应的离子方程式为_________________,T2时该反应的平衡常数为_________________。
(4)硬质合金刀具中含碳化钨(WC),利用电解法可以从碳化钨废料中回收钨。电解时,用碳化钨做阳极,不锈钢做阴极,HCl溶液为电解液,阳极析出钨酸并放出CO2。该阳极反应式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发射“神六”的运载火箭,其推进剂引燃后发生剧烈反应,产生大量高温无色气体(CO2、H2O、N2、NO)从火箭尾部喷出。但在发射现场看到火箭尾部喷出大量红棕色的气体,产生红棕色的气体的原因是( )
A. NO遇空气生成NO2 B. 高温下N2遇空气生成NO2
C. CO2与N2反应生成CO和NO2 D. NO和H2O反应生成H2和NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物Q是一种治疗关节炎的止痛药,合成Q的路线如下:

(1)A的名称为__________,D中含有的官能团名称为__________
(2)E→F的反应类型为__________,G→M的反应类型为__________
(3)B与(ClCH2CO)2O反应生成C和另一有机物H,该反应的化学方程式为__________
(4)有机物J为M的同分异构体。J有多种结构,写出两种满足下列条件的J的结构简式__________。
①苯环上只有两个取代基
②能发生银镜反应
③核磁共振氢谱图中只有5组吸收峰,且峰面积之比为9:2:2:2:1
④酸性条件下能发生水解反应,且水解产物之一能与氯化铁溶液发生显色反应
(5)请写出以1-丙烯、苯、乙酸酐[(CH3CO)2O]为原料根据A→C和M→Q的反应合成 的路线流程图(无机试剂任用,合成路线流程图示例见本题题干):__________
的路线流程图(无机试剂任用,合成路线流程图示例见本题题干):__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知苯乙烯的结构为![]() 。有关该物质的下列说法正确的是( )
。有关该物质的下列说法正确的是( )
A. 该物质在一定条件下和氢气完全加成,加成产物的一溴取代物 6 种
B. 该物质能使溴水和酸性高锰酸钾溶液褪色,褪色原理完全相同
C. 苯乙烯分子的所有原子不可能在同一平面上
D. 除去乙苯中混有的苯乙烯可以通入等量氢气反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 已知冰的熔化热为6.0kJ·mol-1,冰中氢键键能为20kJmol-1,假设每摩尔冰中有2mol氢键,且熔化热完全用于打破冰的氢键,则最多只能破坏冰中15%的氢键
B. 已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为a,Ka=(ca)2/c(1-a)。若加水稀释,,则CH3COOH![]() CH3COO-+H+向右移动,a增大,Ka不变
CH3COO-+H+向右移动,a增大,Ka不变
C. 甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ·mol-1
D. 500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6kJ·mol-1
2NH3(g) △H=-38.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质稀溶液相互反应.无论前者滴入后者,还是后者滴入前者,反应现象相同,且离子方程式也相同的是
A. Ba(HCO3)2溶液与Ba(OH)2溶液 B. NaAlO2溶液与稀硫酸溶液
C. Ca(HCO3)2溶液与NaOH溶液 D. 氨水与硝酸银溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com