
【题目】发射“神六”的运载火箭,其推进剂引燃后发生剧烈反应,产生大量高温无色气体(CO2、H2O、N2、NO)从火箭尾部喷出。但在发射现场看到火箭尾部喷出大量红棕色的气体,产生红棕色的气体的原因是( )
A. NO遇空气生成NO2 B. 高温下N2遇空气生成NO2
C. CO2与N2反应生成CO和NO2 D. NO和H2O反应生成H2和NO2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论正确的是
|
|
|
① | ② | ③ |
A. 由①中的红棕色气体,推断产生的气体一定是混合气体
B. 红棕色气体能表明②中木炭与浓硝酸发生了反应
C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为氧化产物
D. ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知伞形酮可用雷琐苯乙酮和苹果酸在一定条件下反应制得。
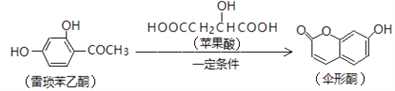
下列说法中正确的是
A. 1mol雷琐苯乙酮最多能与3mol Br2发生取代反应
B. 苹果酸能形成一种缩聚产物是![]()
C. 1mol伞形酮与足量NaOH溶液反应,最多可消耗2mol NaOH
D. 雷琐苯乙酮、苹果酸、伞形酮都能跟FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 铵态氮肥不能与碱性肥料混合施用
B. 液氨可用作致冷剂
C. O2、H2S、SO2、H2均能用浓硫酸干燥,且常温能共存
D. 过量的SO2可使紫色石蕊溶液变红,但不褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸的反应为S+2KNO3+3C![]() K2S+N2↑+3CO2↑,下列说法中正确的是 ( )
K2S+N2↑+3CO2↑,下列说法中正确的是 ( )
A. 该反应中的还原剂为KNO3
B. 该反应中C被还原
C. 若消耗32g S,该反应转移电子数为2 NA
D. 若生成标准状况下气体22.4L,则有0.75 mol物质被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着工业发展和社会进步,人们日益关注环境污染问题.下列措施有助于环境保护的是( )
A. 直接排放电镀废水入海B. 使用无磷洗衣粉
C. 大量使用含硫量高的燃煤D. 实施沙漠绿化工程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:

(1)该“84消毒液”的物质的量浓度约为_________mol·L-1(保留2位有效数字)
(2)某同学取100 mL 该“84消毒液”,按规定标准稀释后用于消毒,稀释后的溶液中:c(Na+)=__________mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数为25%的消毒液。下列说法正确的是__________(填字母)。
A.如下图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器

B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0g
(4)如上面第(3)小题A选项所示,除了应该使用的仪器外,还需要的玻璃仪器是______________。
(5)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用18.4 mol·L-1的浓硫酸配制2000 mL 2.3 mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为__________mol·L-1。
②需用浓硫酸的体积为__________mL。
(6)测定“84消毒液”中次氯酸钠含量的主要步骤:
a.取5.00mL“84消毒液”经稀释等步骤最后定容于250mL容量瓶中;
b.取稀释后的溶液25.00mL于锥形瓶中,加入足量硫酸酸化的KI溶液,在阴凉处静置5分钟;
c.加入5~10滴0.5%的淀粉溶液,溶液变蓝色,再用c mol·L-1Na2S2O3溶液滴定,当消耗的Na2S2O3溶液为VmL时,溶液的蓝色恰好退去,且半分钟内蓝色不再恢复。则“84消毒液”中NaClO的浓度为__________g·L-1。(用c、V表示)
(已知:2KI + H2SO4 + NaClO = I2 + K2SO4 + NaCl + H2O;I2 + 2Na2S2O3 = 2NaI + Na2S4O6)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组设计了如下装置对焦炭还原二氧化硅气体产物的成分进行探究。
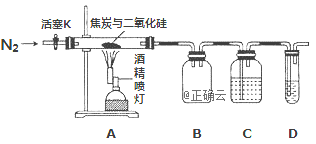
已知:PdCl2溶液可用于检验CO,反应的化学方程式为: CO+PdCl2 + H2O = CO2 +2HCl + Pd↓(产生黑色金属钯粉末,使溶液变浑浊)。
(1)实验时要通入足够长时间的N2,其原因是________
(2)装置B的作用是________
(3)装置C中所盛试剂应为___________
(4)该装置的缺点是________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银耳本身为淡黄色,某地生产的一种“雪耳”,颜色洁白如雪.制作如下:将银耳堆放在密闭状态良好的塑料棚内,棚的一端支口小锅,锅内放有硫磺,加热使硫磺熔化并燃烧,两天左右,“雪耳”就制成了.“雪耳”炖而不烂,对人体有害,制作“雪耳”利用的是
A. 硫的还原性
B. 硫的漂白性
C. 二氧化硫的还原性
D. 二氧化硫的漂白性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com