
【题目】下列说法不正确的是( )
A. 铵态氮肥不能与碱性肥料混合施用
B. 液氨可用作致冷剂
C. O2、H2S、SO2、H2均能用浓硫酸干燥,且常温能共存
D. 过量的SO2可使紫色石蕊溶液变红,但不褪色
科目:高中化学 来源: 题型:
【题目】下列有关原子结构、元素性质的说法正确的是( )
A. Si、P、S、Cl元素的单质与氢气化合越来越容易
B. 元素原子最外层电子数越多,元素金属性越强
C. 元素周期表共有18列,第3列是第ⅠB族,第17列是第ⅦA族
D. F、O、Mg、Na原子半径逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用浓度为0.1000mol/L的盐酸分别逐滴加入到20.00mL0.1000mol/L的两种一元碱MOH、ROH溶液中,pH随盐酸溶液体积的变化如图所示。下列说法正确的是
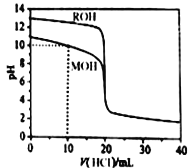
A. pH=10时,溶液中微粒浓度的关系是:c(M+)> c(Cl-)> c(MOH) >c(OH-)>c(H+)
B. 将上述MOH、ROH溶液等体积混合后,用盐酸滴定至MOH恰好反应时,溶液中离子浓度一直保持的关系是:c(R+)>c(M+)>c(OH-)>c(H+)
C. 10mL<V(HCl)<20mL时,溶液中微粒浓度的关系是:c(M+)+c(MOH)<c(Cl-)
D. V(HCl)>20mL时,不可能存在:c(Cl-)>c(M+)=c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨(74W)是熔点最高的金属,是重要的战略物资。自然界中钨矿石的主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含少量Si、P、As的化合物。由黑钨矿冶炼钨的工艺流程如下:

已知:①滤渣I的主要成份是Fe2O3、MnO2。②上述流程中,除最后一步外,其余步骤钨的化合价未变。③常温下钨酸难溶于水。
回答下列问题:
(1)钨酸中钨元素的化合价为_________,写出MnWO4在熔融条件下发生碱分解反应生成MnO2的化学方程式___________________________________________。
(2)上述流程中向粗钨酸钠溶液中加硫酸调pH=10后,溶液中的杂质阴离子为SiO32-、HAsO32-、HAsO42-、HPO42-等,则“净化”过程中,加入H2O2时发生反应的离子方程式为_______________________________。
(3)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线。则T1________T2(填“>”或“<”)。
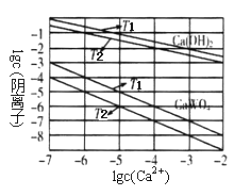
将钨酸钠溶液加入石灰乳得到大量钨酸钙,发生反应的离子方程式为_________________,T2时该反应的平衡常数为_________________。
(4)硬质合金刀具中含碳化钨(WC),利用电解法可以从碳化钨废料中回收钨。电解时,用碳化钨做阳极,不锈钢做阴极,HCl溶液为电解液,阳极析出钨酸并放出CO2。该阳极反应式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色。
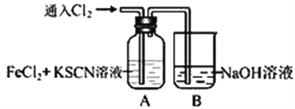
(1)B中反应的离子方程式是________________________________________________。
(2)为了探究A中溶液由红色变为黄色的原因,甲同学进行如下实验。取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在__________________。
(3)资料显示:SCN -的电子式为 ![]() 。甲同学猜想SCN―可能被Cl2氧化了,他进行了如下研究。①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN―中被氧化的元素是__________________。
。甲同学猜想SCN―可能被Cl2氧化了,他进行了如下研究。①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN―中被氧化的元素是__________________。
②甲同学通过实验证明了SCN―中氮元素转化为NO3― ,已知SCN―中碳元素没有被氧化,若SCN―与Cl2反应生成0.5mol CO2,则转移电子的物质的量是_______________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发射“神六”的运载火箭,其推进剂引燃后发生剧烈反应,产生大量高温无色气体(CO2、H2O、N2、NO)从火箭尾部喷出。但在发射现场看到火箭尾部喷出大量红棕色的气体,产生红棕色的气体的原因是( )
A. NO遇空气生成NO2 B. 高温下N2遇空气生成NO2
C. CO2与N2反应生成CO和NO2 D. NO和H2O反应生成H2和NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素非金属性强弱比较的实验研究;
乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是蘸有溴化钠溶液的棉花、湿润的淀粉碘化钾试纸、湿润的红色纸条。
已知常温下浓盐酸与高锰酸钾能反应生成氯气;
可选择的试剂有:大理石、碳酸钠粉末、浓盐酸、稀硝酸、硅酸钠溶液。
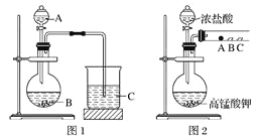
(1)甲同学实验中(图1):
①从给出试剂中选出最佳物质(填化学式):A________,B________。
②烧杯C中发生反应的离子方程式为__________________________。
(2)乙同学实验中(图2):
①写出A处反应的离子方程式________________________。
②B处实验现象是________________________。
③若高锰酸钾的还原产物为Mn2+,当有0.04 mol高锰酸钾参加反应时,则可生成标准状况下的氯气的体积为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com