
【题目】下列物质中属于纯净物的是( )
A.氯水B.液氯C.次氯酸溶液D.液态空气
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某离子反应涉及到H2O、ClO-、NH4+、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,下列说法正确的是
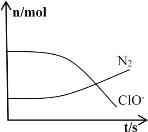
A. 该反应中Cl-为氧化产物
B. 消耗1mol还原剂,转移6mol电子
C. NH4+被ClO-氧化成N2
D. 反应后溶液的酸性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分別取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液。在FeCl2溶液中需加入少量铁屑,其目的是___________。
(2)甲组同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液変红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为____________。
(3)乙组同学认为甲组的实验不够谨慎,该组同学在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是__________。
(4)丙组同学取10mL0.1mol/LKI溶液,加入6mL0.1mol/LFeCl3溶液混合。分別取2mL此溶液于3支武管中进行如下实验:
①第一支试管中加入1mLCCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是_______(填离子符号);实验①和实验③说明:在I-过量的情况下,溶液中仍含有_____(填离子符号);由此可以证明该氧化还原反应为___________。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为________。一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成,产生气泡的原因是__________。生成沉淀的原因是______________(用平衡移动原理解释)。
(6)某铁的氧化物(FexO)1.52g溶于足量盐酸中,向所得溶液通入标准状况下112mLCl2,恰好将Fe2+完全氧化,则x值为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论正确的是
|
|
|
① | ② | ③ |
A. 由①中的红棕色气体,推断产生的气体一定是混合气体
B. 红棕色气体能表明②中木炭与浓硝酸发生了反应
C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为氧化产物
D. ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铊(Tl)是某超导材料的组成元素之一,已知铊位于第六周期ⅢA族。Tl3+与Ag在酸性介质中发生反应:Tl3++2Ag![]() Tl++2Ag+。下列推断正确的是
Tl++2Ag+。下列推断正确的是
A. Tl+最外层有1个电子
B. Tl3+的氧化性比Ag+弱
C. Tl能形成+3价和+1价的化合物
D. Tl+的还原性比Ag强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于药物的使用说法不正确的是( )
A. 使用青霉素时,为防止过敏反应的发生,一定要进行皮肤敏感实验
B. 虽然药物能治病,但大部分药物有毒副作用
C. 兴奋剂能使人兴奋,产生愉悦,因此青少年不可自行服用
D. 我们生病了都可以到药店自己买药吃,不用到医院
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向溶质为FeBr2、FeI2的溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,结果溶液变为血红色,则下列叙述不正确的是 ( )
A. 原溶液中的Br-不一定被氧化
B. 通入氯气之后原溶液中的Fe2+一定被氧化
C. 不能确定通入氯气之后的溶液中是否存在Fe2+
D. 若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgNO3溶液,能产生黄色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知伞形酮可用雷琐苯乙酮和苹果酸在一定条件下反应制得。
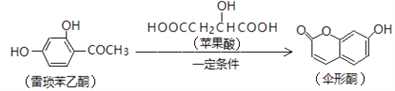
下列说法中正确的是
A. 1mol雷琐苯乙酮最多能与3mol Br2发生取代反应
B. 苹果酸能形成一种缩聚产物是![]()
C. 1mol伞形酮与足量NaOH溶液反应,最多可消耗2mol NaOH
D. 雷琐苯乙酮、苹果酸、伞形酮都能跟FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:

(1)该“84消毒液”的物质的量浓度约为_________mol·L-1(保留2位有效数字)
(2)某同学取100 mL 该“84消毒液”,按规定标准稀释后用于消毒,稀释后的溶液中:c(Na+)=__________mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数为25%的消毒液。下列说法正确的是__________(填字母)。
A.如下图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器

B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0g
(4)如上面第(3)小题A选项所示,除了应该使用的仪器外,还需要的玻璃仪器是______________。
(5)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用18.4 mol·L-1的浓硫酸配制2000 mL 2.3 mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为__________mol·L-1。
②需用浓硫酸的体积为__________mL。
(6)测定“84消毒液”中次氯酸钠含量的主要步骤:
a.取5.00mL“84消毒液”经稀释等步骤最后定容于250mL容量瓶中;
b.取稀释后的溶液25.00mL于锥形瓶中,加入足量硫酸酸化的KI溶液,在阴凉处静置5分钟;
c.加入5~10滴0.5%的淀粉溶液,溶液变蓝色,再用c mol·L-1Na2S2O3溶液滴定,当消耗的Na2S2O3溶液为VmL时,溶液的蓝色恰好退去,且半分钟内蓝色不再恢复。则“84消毒液”中NaClO的浓度为__________g·L-1。(用c、V表示)
(已知:2KI + H2SO4 + NaClO = I2 + K2SO4 + NaCl + H2O;I2 + 2Na2S2O3 = 2NaI + Na2S4O6)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com