
【题目】M、R均为主族元素,已知M的一个原子失去2个电子,R的一个原子得到1个电子后形成稀有气体元素的电子层结构。下列关于M与R形成的化合物的叙述正确的是( )
A. M与R可以形成MR2型离子化合物
B. 在MR2中M的离子半径比R的离子半径大
C. 形成的两种离子分别是M+和R2-
D. MR2的电子式为![]()
【答案】A
【解析】
元素M的一个原子失去2个电子得到稳定结构,故M处于ⅡA族,R的一个原子得到一个电子后形成稀有气体元素的电子层结构,故处于ⅦA族,二者可以形成MR2型离子化合物,据此解答。
元素M的一个原子失去2个电子得到稳定结构,故M处于ⅡA族,R的一个原子得到一个电子后形成稀有气体元素的电子层结构,故处于ⅦA族,二者可以形成MR2型离子化合物,据此解答。则
A.M形成+2价阳离子,R形成-1价阴离子,二者可以形成MR2型离子化合物,故A正确;
B.离子电子层与核电荷数不能确定,故离子半径大小不能确定,M的离子半径可能比R的离子半径小,也可能大,如Ca2+<Cl-,Ba2+>Cl-,故B错误;
C.形成的两种离子分别是M2+和R-,故C错误;
D.MR2的电子式为![]() ,故D错误,
,故D错误,
故答案选A。


科目:高中化学 来源: 题型:
【题目】在宏观—微观—符号之间建立联系,是化学学科特有的思维方式。汽车尾气是造成大气污染的主要原因之一,在汽车排气管上安装“催化转换器”便可以使汽车的尾气转换成无毒气体。如用●表示碳原子,用○表示氧原子,用![]() 表示氮原子,下图为气体转换的微观过程。请根据图示回答下列问题:
表示氮原子,下图为气体转换的微观过程。请根据图示回答下列问题:
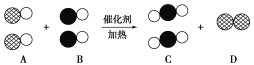
(1)A、B、C三种物质可以归为一类的依据是_________________________________
(2)将C归为化合物,将D归为单质的理由是_______________。
(3)图示反应用化学反应方程式表示为_________化学变化过程中消耗的A物质和生成的C物质的质量比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物Q是一种治疗关节炎的止痛药,合成Q的路线如下:

(1)A的名称为__________,D中含有的官能团名称为__________
(2)E→F的反应类型为__________,G→M的反应类型为__________
(3)B与(ClCH2CO)2O反应生成C和另一有机物H,该反应的化学方程式为__________
(4)有机物J为M的同分异构体。J有多种结构,写出两种满足下列条件的J的结构简式__________。
①苯环上只有两个取代基
②能发生银镜反应
③核磁共振氢谱图中只有5组吸收峰,且峰面积之比为9:2:2:2:1
④酸性条件下能发生水解反应,且水解产物之一能与氯化铁溶液发生显色反应
(5)请写出以1-丙烯、苯、乙酸酐[(CH3CO)2O]为原料根据A→C和M→Q的反应合成 的路线流程图(无机试剂任用,合成路线流程图示例见本题题干):__________
的路线流程图(无机试剂任用,合成路线流程图示例见本题题干):__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知苯乙烯的结构为![]() 。有关该物质的下列说法正确的是( )
。有关该物质的下列说法正确的是( )
A. 该物质在一定条件下和氢气完全加成,加成产物的一溴取代物 6 种
B. 该物质能使溴水和酸性高锰酸钾溶液褪色,褪色原理完全相同
C. 苯乙烯分子的所有原子不可能在同一平面上
D. 除去乙苯中混有的苯乙烯可以通入等量氢气反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了减少钢管因锈蚀造成的损失,某城市拟用如图方法保护埋在酸性土壤中的钢管。下列有关说法错误的是( )

A. 在潮湿的酸性土壤中钢管主要发生析氢腐蚀
B. 在潮湿的酸性土壤中金属棒M将电子通过导线流向钢管
C. 在潮湿的酸性士壤中H+向金属棒M移动,抑制H+与铁的反应
D. 该方法称为牺牲阳极的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 已知冰的熔化热为6.0kJ·mol-1,冰中氢键键能为20kJmol-1,假设每摩尔冰中有2mol氢键,且熔化热完全用于打破冰的氢键,则最多只能破坏冰中15%的氢键
B. 已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为a,Ka=(ca)2/c(1-a)。若加水稀释,,则CH3COOH![]() CH3COO-+H+向右移动,a增大,Ka不变
CH3COO-+H+向右移动,a增大,Ka不变
C. 甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ·mol-1
D. 500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6kJ·mol-1
2NH3(g) △H=-38.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用工业冶炼硫酸铜(含有Fe2+、AsO2-、Ca2+等杂质)提纯制备电镀硫酸铜的生产流程如下:

已知:①Fe3+、Cu2+开始沉淀的pH分别2.7、5.4,完全沉淀的pH分别为3.7、6.4。
②Ksp[Cu(OH)2]=2×10-20
③AsO2-+H2O2+H+=H3AsO4, H3AsO4+Fe3+=FeAsO4↓+3H+
(1)溶解操作中需要配制含铜32 g·L-1的硫酸铜溶液1.0 L,需要称量冶炼级硫酸铜的质量至少为___________g。
(2)测定溶解液中的Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4溶液应使用
________(“酸式”或“碱式”)滴定管,其中反应离子方程式为:______________________。若要检验调节pH后溶液中的Fe3+已除尽的方法是___________________________。
(3)氧化后需要将溶液进行稀释及调节溶液的pH=5,则稀释后的溶液中铜离子浓度最大不能超过____________mol·L-1。
(4)固体Ⅰ的主要成分除 FeAsO4 、Fe(OH)3外还有__________________,由溶液Ⅰ获得CuSO4·H2O,需要经过________ 、____________、过滤、洗涤、干燥操作。
(5)利用以上电镀级硫酸铜作为电解质溶液,电解粗铜(含锌、银、铂杂质)制备纯铜,写出阳极发生的电极反应式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z三种主族元素在元素周期表中的位置如图所示。设X的原子序数为a,则下列说法不正确的是( )

A. Y的原子序数可能为a-17 B. Z的原子序数可能为a+31
C. X、Y、Z可能为短周期元素 D. Y与Z的原子序数之和可能为2a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500 多年前,一艘载着天然苏打晶体(Na2CO3·10H2O)的商船在航行中搁浅,船员们便在附近的沙滩上用几块苏打晶体支锅煮饭。之后他们惊奇地发现,在苏打与沙粒接触的地方出现了许多晶莹发亮的珠子。回答下列问题:
(1)沙滩上沙粒的主要成分为_______(填化学式)。
(2)上述晶莹发亮的珠子可能是______(填字母)。
A. 水晶颗粒 B.无水碳酸钠 C.晶体硅 D.玻璃珠
(3)生成该珠子时发生反应的化学方程式为_____________。
(4)氢氟酸常用作玻璃的蚀刻剂,原因是______________(用化学方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com