
【题目】已知某市售“84消毒液”瓶体部分标签如下图所示,该“84 消毒液”通常稀释100 倍(体积之比)后使用.请回答下列问题:

(1)该“84 消毒液”的物质的量浓度约为__mol/L.( 保留小数点后 1 位)
(2)该同学参阅此“84 消毒液”的配方,欲用NaClO固体配制480mL 与市售物质的量浓度相同的“84 消毒液”,下列说法中正确的是__( 填序号).
A.如下图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0g

(3)“84 消毒液”与稀硫酸混合使用可增强其消毒能力,某消毒小组人员用 98%( 密度为1.84g/cm3)的浓硫酸配制 500mL 2.3mol/L 的稀硫酸用于增强“84 消毒液”的消毒能力.
①需用浓硫酸的体积为__mL.
②取用任意体积的浓硫酸时,下列物理量中不随所取体积的多少而变化的是__。
A.溶液中H2SO4的物质的量 B.溶液的浓度
C.溶液的质量 D.溶液的密度
③对浓硫酸稀释过程中遇到下列情况,使所配制的硫酸浓度大于2.3mol/L有__。
A.未经冷却趁热将溶液注入容量瓶中
B.摇匀后发现液面低于刻度线,再加水至刻度线
C.容量瓶中原有少量蒸馏水
D.定容时俯视观察液面.
【答案】 4.0 C 62.5 BD AD
【解析】试题(1)c(NaClO)=c=![]() =
=![]() =4.0molL-1,故答案为:4.0;
=4.0molL-1,故答案为:4.0;
(2)A.需用托盘天平称量NaClO固体,需用烧杯来溶解NaClO,需用玻璃棒进行搅拌和引流,需用容量瓶和胶头滴管来定容,图示的A、B、不需要,但还需玻璃棒和胶头滴管,故A错误;B.配制过程中需要加入水,所以经洗涤干净的容量瓶不必烘干后再使用,故B错误;C.由于NaClO易吸收空气中的H2O、CO2而变质,所以商品NaClO可能部分变质导致NaClO减少,配制的溶液中溶质的物质的量减小,结果偏低,故C正确;D.应选取500mL的容量瓶进行配制,然后取出480mL即可,所以需要NaClO的质量:0.5L×4.0molL-1×74.5gmol-1=149g,故D错误;故答案为:C;
(3)①溶液稀释前后溶质的物质的量不变,浓硫酸的浓度为c=![]() =18.4mol/L,假设需要浓硫酸的体积为V,则V×18.4mol/L=0.5L×2.3mol/L,V=0.625L=62.5mL,故答案为:62.5;
=18.4mol/L,假设需要浓硫酸的体积为V,则V×18.4mol/L=0.5L×2.3mol/L,V=0.625L=62.5mL,故答案为:62.5;
②A.溶液中H2SO4的物质的量n=cV,与体积有关,错误;B.溶液具有均一性,溶液的浓度与体积无关,正确;C.溶液的质量m=ρV,与体积有关,错误;D.溶液具有均一性,溶液的密度与体积无关,正确;故选BD;
③A.未经冷却趁热将溶液注入容量瓶中,导致溶液体积偏小,浓度偏大,正确;B.摇匀后发现液面低于刻度线,再加水至刻度线,导致溶液体积偏大,浓度偏小,错误;C.容量瓶中原有少量蒸馏水对结果无影响,错误;D.定容时俯视观察液面,导致溶液体积偏小,浓度偏大,正确;故选AD。


科目:高中化学 来源: 题型:
【题目】锡是大名鼎鼎的“五金”——金、银、铜、铁、锡之一,早在远古时代,人们便发现并使用了锡。回答下列问题:
(1)锡是50号元素,在元素周期表中位于________区。
(2)SnO2是一种重要的半导体传感器材料,用来制备灵敏度高的气敏传感器,SnO2与熔融NaOH反应生成Na2SnO3,Na2SnO3中阴离子的空间构型为________。
(3)比较下列卤化锡的熔点和沸点,分析其变化规律及原因____________________________________
SnCl4 | SnBr4 | SnI4 | |
熔点/℃ | -33 | 31 | 144.5 |
沸点/℃ | 114.1 | 202 | 364 |
(4)汽车废气中常含有有毒的一氧化碳气体,但在二氧化锡的催化下,在300 ℃时,一氧化碳可大部分转化为二氧化碳。C、O、Sn电负性由大至小的顺序是__________________________________________。
(5)灰锡具有金刚石型结构,其中Sn原子的杂化方式为________,微粒之间存在的作用力是__________________________________。
(6)①原子坐标参数,表示晶胞内部各原子的相对位置,如图为灰锡的晶胞,其中原子坐标参数A为(0,0,0),B为(1/2,0/1/2),则D为(1/4,___ ,___ )。锡的配位数为________。
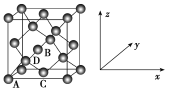
②已知灰锡的晶胞参数a=0.648 9 nm,其密度为______ g·cm-3(NA为6.02×1023 mol-1,不必算出结果,写出简化后的计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种瓦斯分析仪(下图甲)能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如下图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动。下列有关叙述正确的的是( )

A. 瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a
B. 电极a的反应式为:CH4+5O2-―8e-=CO32- +2H2O
C. 电极b是正极, O2-由电极a流向电极b
D. 当固体电解质中有1 mol O2-通过时,电子转移4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识回答下列问题。
(1)已知Ksp(BaCO3) =2.6×l0-9,Ksp(BaSO4)=1.1×10-10。
①BaCO3在20 mL 0.01 mol·L-1Na2CO3溶液中的Ksp _________(填“大于”、“小于”或“等于”)其在20 mL 0.01 mol·L-1 BaCl2溶液中的Ksp
②现将浓度为2×10-4mol/LNa2CO3溶液与BaCl2溶液等体积混合,则生成BaCO3沉淀所需BaCl2溶液的最小浓度为_______mol/L。
③向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中c(CO32—)/c(SO42—)=___________(保留三位有效数字)。
(2)已知25℃ 时,Ksp[AgCl]=1.8×10-10,现将足量氯化银分别放入:a.100mL蒸馏水中;b.100mL 0.2 mol/LAgNO3溶液中;c.100mL 0.1 mol/L氯化铝溶液中;d.100mL 0.1 mol/L盐酸溶液中。充分搅抖后,相同温度下银离子浓度由大到小的顺序是_______________。(填写序号);b中氯离子的浓度为__________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Zn在现代工业中对于电池制造上有不可磨灭的地位,明朝末年宋应星所著的《天工开物》一书中就有世界上最早的关于炼锌技术的记载。回答下列问题:
(1)Zn基态原子的电子排布式为___________,4s能级上的成对电子数为___________。
(2)葡萄糖酸锌{[CH2OH( CHOH)4COO]2Zn}是目前市场上流行的补锌剂。葡萄糖酸锌中碳原子杂化形式有___________,C、H两元素的第一电离能的大小关系为___________________。
(3)ZnCl2与NH3形成的配合物[Zn(NH3)4]Cl2中,存在___________(填字母)。
A离子键 B.σ键 C.π键
(4)锌与某非金属元素X形成的化合物晶胞如图所示,其中Zn和X通过共价键结合,该化合物中Zn与X的原子个数之比为___________。
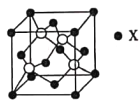
(5)在图示晶胞中若只考查X的排列方式,则X的堆积方式属于金属晶体堆积方式中的___________堆积;设阿伏加德罗常数的数值为NA,该晶胞中Zn的半径为r1nm,X的半径为r2nm,X的相对原子质量为M,则该晶体的密度为___________g·cm-3(用含r1、r2、M、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 加水稀释0.01 mol·L-1的CH3COOH溶液,溶液中c(OH-)减小
B. 室温时,0.1 mol·L-1的某一元酸HA在水中有0.1%发生电离,则该溶液的pH=4
C. 氨水加水稀释后,溶液中![]() 的值增大
的值增大
D. 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为 MnO2 + 4HCl (浓)![]() MnCl2+ Cl2↑ +2H2O ,欲制得标准状况下4.48L氯气,
MnCl2+ Cl2↑ +2H2O ,欲制得标准状况下4.48L氯气,
(1)参加反应的HCl的质量是 __________ 克
(2)反应中实际被氧化的HCl的物质的量是__________ mol
(3)反应中转移的电子个数为 ______________ .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com