
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:
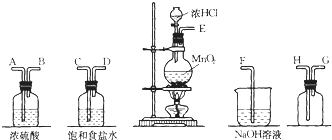
(1)连接上述仪器的正确顺序是:E接__,__接__,__接__,__接F。
(2)气体发生装置中进行的反应化学方程式是__;当0.5molMnO2参与反应时,生成的Cl2在标准状况下的体积约__。
(3)在装置中:①饱和食盐水的作用是__,②浓硫酸的作用是___。
(4)化学实验中检验是否有Cl2产生常用湿润的淀粉-KI试纸。如果有Cl2产生,可观察到的现象是___。
(5)写出尾气吸收装置中进行的反应的化学方程式__。
【答案】C D A B H G 4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O 11.2L 除去Cl2中的HCl 干燥氯气 试纸变蓝 Cl2+2NaOH=NaCl+NaClO+H2O
MnCl2+Cl2↑+2H2O 11.2L 除去Cl2中的HCl 干燥氯气 试纸变蓝 Cl2+2NaOH=NaCl+NaClO+H2O
【解析】
(1)制备干燥纯净的氯气的步骤是制取、除杂、干燥、收集、尾气处理;
(2)气体发生装置D中是二氧化锰、浓盐酸在加热条件下生成氯化锰、氯气、水;根据方程式计算生成的Cl2在标准状况下的体积;
(3)①饱和食盐水可以除去氯气中的氯化氢,②浓硫酸具有干燥作用;
(4)淀粉遇碘单质变蓝色;
(5)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水;
(1)制备干燥纯净的氯气的步骤包括:制取、用饱和食盐水除去氯气中的氯化氢、用浓硫酸干燥氯气、用向上排空气法收集收集氯气、用氢氧化钠溶液吸收尾气,所以连接上述仪器的正确顺序是:E接C,D接A,B接H,G接F;
(2)气体发生装置D中是二氧化锰、浓盐酸在加热条件下生成氯化锰、氯气、水,反应方程式是4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
设生成氯气的体积是VL;
4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
1mol 22.4L
0.5mol VL
![]()
V=11.2L;
(3)①饱和食盐水可以除去氯气中的氯化氢,饱和食盐水的作用是除去Cl2中的HCl ;②浓硫酸具有干燥作用,所以浓硫酸的作用是干燥氯气;
(4)Cl2能置换出KI中的碘,淀粉遇碘单质变蓝色。如果有Cl2产生,可观察到的现象是试纸变蓝;
(5)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,反应方程式是Cl2+2NaOH=NaCl+NaClO+H2O。


科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中,有关微粒物质的量浓度关系正确的是( )
A. 0.1mol·L-1(NH4)2Fe(SO4)2溶液:c(![]() )>c(
)>c(![]() )>c(H+)>c(Fe2+)
)>c(H+)>c(Fe2+)
B. 将100mL 0.1mol·L-1Na2CO3溶液逐滴滴加到100mL 0.1mol·L-1盐酸中:c(Na+)>c(C1-)>c(![]() )>c(
)>c(![]() )
)
C. pH=12的NaOH溶液与等体积pH=2的醋酸溶液混合后:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D. 0.1mol·L-1NaHCO3溶液:c(H+)+2c(H2CO3)=c(OH-)+c(![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家用![]() Ca轰击
Ca轰击![]() Bk(锫)生成
Bk(锫)生成![]() Up和
Up和![]() Up,Up可能是科学家一直寻找的第117号元素。下列关于
Up,Up可能是科学家一直寻找的第117号元素。下列关于![]() Ca、
Ca、![]() Bk(锫)、
Bk(锫)、![]() Up和
Up和![]() Up说法中正确的是( )
Up说法中正确的是( )
A. 117号元素的相对原子质量为293.5
B. ![]() Up和
Up和![]() Up互为同位素
Up互为同位素
C. ![]() Ca、
Ca、![]() Bk(锫)、
Bk(锫)、![]() Up和
Up和![]() Up表示四种核素,属于四种元素
Up表示四种核素,属于四种元素
D. 该轰击表明通过化学反应可以合成新元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.一氧化碳的摩尔质量与6.02×1023个氮气分子的质量在数值上相等
B.6.02×1023个N2和6.02×1023个O2的质量比等于7︰8
C.3.2gO2所含的原子数目约为0.2×6.02×1023
D.常温、常压下,0.5×6.02×1023个二氧化碳分子质量是44g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、体积为2.0L的密闭容器中通入1.0mol N2和1.0mol H2发生合成氨反应,20min后达到平衡,测得反应放出的热量为18.4kJ,混合气体的总物质的量为1.6mol,请回答下列问题:
(1)从开始反应至达到平衡时,用NH3表示该反应的化学反应速率ν(NH3)=____。
(2)平衡时,N2的转化率为____,NH3的体积分数为____,平衡时体系的压强为起始时压强的____倍。
(3)该反应的热化学方程式为____。
(4)若拆开1mol H-H键和1mol N![]() N键需要的能量分别是436kJ和946kJ,则拆开1mol N-H键需要的能量是____kJ。
N键需要的能量分别是436kJ和946kJ,则拆开1mol N-H键需要的能量是____kJ。
(5)判断该反应达到平衡状态的依据是____(填序号)。
①单位时间内消耗1mol N2的同时消耗了3mol H2;
②单位时间内断裂1mol N≡N的同时断裂了6mol N–H;
③ν正(N2)= ν逆(NH3);
④NH3的物质的量分数不再随时间而变化;
⑤容器内气体的压强不再随时间而变化的状态;
⑥容器内气体的密度不再随时间而变化的状态;
⑦c(N2):c(H2):c(NH3)=1:3:2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列相关化学用语表述正确的是( )
A. NH4Cl的电子式: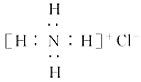
B. C原子的轨道表示式: ![]()
C. 冰醋酸为共价化合物,受热熔融:CH3COOH![]() CH3COO-+H+
CH3COO-+H+
D. Fe2+基态核外电子排布式为1s22s22p63s23p63d6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤及工业废气中的SO2是形成酸雨的主要原因,消除SO2是减少酸雨形成的有效方法。完成下列问题:
(1)已知:4FeS2(s)+11O2(g)═2Fe2O3(s)+8SO2(g)△H=﹣3412.0kJmol﹣1
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=﹣25.0 kJmol﹣1
2C(s)+O2(g)═2CO(g)△H=﹣221.0 kJmol﹣1
则2FeS2(s)+7O2(g)+3C(s)═2Fe(s)+3CO2(g)+4SO2(g)△H=_____kJmol﹣1。
(2)碱性NaClO2溶液脱硫法
SO2与碱性NaClO2溶液反应的离子方程式为2SO2+ClO2﹣+4OH﹣2SO42﹣+C1﹣+2H2O,已知pc=﹣lgc(SO2)。在刚性容器中,将含SO2的废气通入碱性NaClO2溶液中,测得pc与温度的关系如图所示。
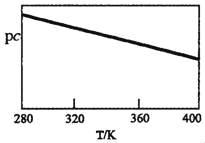
由图分析可知,该脱硫反应是_____反应(填“放热”或“吸热”);若温度不变,增大压强,该脱硫反应的平衡常数K_____(填“增大”、“减小”或“不变”)。
(3)燃料细菌脱硫法
①含FeS2的燃煤可用氧化亚铁硫杆菌(T.f)、氧化亚铁微螺菌(L.f)、氧化硫硫杆菌(T.t)进行脱硫,其脱硫过程如图所示:
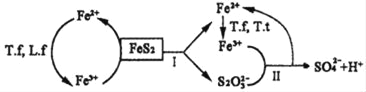
已知:脱硫总反应为:FeS2+14Fe3++8H2O═2SO42﹣+15Fe2++16H+,
Ⅰ反应的化学方程式为:FeS2+6Fe3++3H2O═S2O32﹣+7Fe2++6H+;
写出Ⅱ反应的化学方程式_____。
②在上述脱硫反应中,氧化亚铁硫杆菌(T.f)与Fe3+的形成过程可视为下图所示的原电池:

该细胞膜为_____(填“阳离子交换膜”或“阴离子交换膜”)。该电池的正极电极反应式为_____。该方法在高温下脱硫效率大大降低,原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将反应2Fe3++2I-2Fe2++I2设计成如下图所示的原电池。

下列说法不正确的是( )
A.盐桥中的K+移向FeCl3溶液
B.反应开始时,乙中石墨电极上发生氧化反应
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列说法正确的是____________。
A 漂白粉在空气中容易失效的原因是次氯酸钙易分解为氯化钙和氧气
B 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,证明该溶液一定是钠盐溶液
C 用托盘天平可以准确称量氢氧化钠固体8.80g
D 烧杯中红褐色的透明液体是氢氧化铁胶体还是溴水用可见光束可以鉴别
E 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
F 分液操作时,待下层液体流出后,及时关闭活塞并从上口倒出上层液体
(2)现有四瓶溶液分别是NH4NO3溶液、NaCl溶液、(NH4)2 SO4溶液、MgSO4溶液,可用于鉴别它们一种试剂(可适当加热)是_______。(填试剂名称)
(3)如果采用如图装置完成收集氯气,气体的进入口是__________(填写字母)。
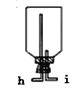
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com