
【题目】在恒温、体积为2.0L的密闭容器中通入1.0mol N2和1.0mol H2发生合成氨反应,20min后达到平衡,测得反应放出的热量为18.4kJ,混合气体的总物质的量为1.6mol,请回答下列问题:
(1)从开始反应至达到平衡时,用NH3表示该反应的化学反应速率ν(NH3)=____。
(2)平衡时,N2的转化率为____,NH3的体积分数为____,平衡时体系的压强为起始时压强的____倍。
(3)该反应的热化学方程式为____。
(4)若拆开1mol H-H键和1mol N![]() N键需要的能量分别是436kJ和946kJ,则拆开1mol N-H键需要的能量是____kJ。
N键需要的能量分别是436kJ和946kJ,则拆开1mol N-H键需要的能量是____kJ。
(5)判断该反应达到平衡状态的依据是____(填序号)。
①单位时间内消耗1mol N2的同时消耗了3mol H2;
②单位时间内断裂1mol N≡N的同时断裂了6mol N–H;
③ν正(N2)= ν逆(NH3);
④NH3的物质的量分数不再随时间而变化;
⑤容器内气体的压强不再随时间而变化的状态;
⑥容器内气体的密度不再随时间而变化的状态;
⑦c(N2):c(H2):c(NH3)=1:3:2。
【答案】0.01mol/(Lmin) 20% 25% 0.8 N2 (g)+3H2 (g) 2NH3(g) H= -92kJ /mol 391 ②④⑤
【解析】
(1)设反应消耗氮气的量为xmol,
N2 + 3H2 2NH3
起始量 1 1 0
变化量 x 3x 2x
平衡量 1-x 1-3x 2x
20min后达到平衡,混合气体的总物质的量为1.6mol,所以1-x+1-3x+2x=1.6,解之得x=0.2mol;根据v=c/t计算出v(NH3);根据α=变化量/起始量×100%计算出N2的转化率;同一条件下,气体的体积之比和气体的物质的量成正比,计算出氨气的体积分数;同一条件下,气体的压强之比和气体的物质的量成正比,据此计算出平衡时体系的压强与起始时压强之比;根据H=反应物断键吸收能量-生成物成键放出的热量,计算出拆开1mol N-H键需要的能量;
(2)根据平衡状态判断标准:v正=v逆,各物质的浓度保持不变及由此衍生出的物理量进行分析判断。
(1)在恒温、体积为2.0L的密闭容器中发生合成氨的反应,设反应消耗氮气的量为x mol,
N2 + 3H2 2NH3
起始量 1 1 0
变化量 x 3x 2x
平衡量 1-x 1-3x 2x
20min后达到平衡,混合气体的总物质的量为1.6mol,所以1-x+1-3x+2x=1.6,解之得x=0.2mol;c(NH3)=0.4mol/2L=0.2mol/L;v(NH3)= 0.2mol/L/20min=0.01mol/(Lmin);
(2)根据(1)分析可知,平衡时,N2的转化率为0.2mol/1mol×100%=20%;同一条件下,气体的压强之比和气体的物质的量成正比,所以平衡时气体的总量为1.6mol同一条件下,气体的体积之比和气体的物质的量成正比,所以平衡时氨气的体积分数为0.4mol/1.6mol×100%=25%;起始时气体的总量为2mol,平衡时体系的压强为起始时压强的1.6mol/2mol=0.8倍;
(3)根据(1)分子可知,当有0.2mol氮气参加反应,反应放出的热量为18.4kJ,所以当1mol氮气参加反应,放出的热量为92kJ;所以该反应的热化学方程式为:N2(g)+3H2 (g) 2NH3(g) H= -92kJ /mol;
(4)设拆开1mol N-H键需要的能量是x kJ,根据N2(g)+ 3H2(g) 2NH3(g) H= -92kJ /mol反应可知,H=反应物断键吸收能量-生成物成键放出的热量,带入数值:946kJ+3×436kJ-2×3×x= -92 kJ,解之得x=391kJ;
(5)①单位时间内消耗1mol N2的同时消耗了3mol H2,均表示正反应速率,反应始终按该比例关系进行,不能判断反应达到平衡状态,故错误;
②单位时间内断裂1molN≡N键的同时,断裂了6molN–H键,体现了2v正(N2)=v逆(NH3),可以判定反应达到平衡状态,故正确;
③ν正(N2)= ν逆(NH3),不满足速率之比和系数成正比的关系,不能判定反应达到平衡状态,故错误;
④NH3的物质的量分数不再随时间而变化,即ν逆(NH3)= ν正(NH3),可以判定反应达到平衡状态,故正确;
⑤条件一定时,气体的压强和气体的物质的量成正比;随反应进行混合气体总物质的量减小,恒温恒容下混合气体的压强随着反应的进行,压强在变小,而压强不再改变时,反应达平衡状态,故正确;
⑥混合气体总质量不变,容器容积不变,根据ρ=m/V可知,混合气体的密度不始终不变,不能判定反应达到平衡状态,故错误;
⑦用N2、H2、NH3表示的反应速率数值之比为1:3:2,反应开始即按该比例关系进行,不能判定反应达到平衡状态,故错误;
故答案选②④⑤。


 每课必练系列答案
每课必练系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.某物质不是电解质就是非电解质
B.碳酸氢钠在水中的电离方程式:![]()
C.能电离出H+ 的化合物都是酸
D.导电性强的溶液里自由移动的离子数目不一定比导电性弱的溶液里自由移动的离子数多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于Na2CO3和NaHCO3的说法正确的是 ( )
A.在水中的溶解性:NaHCO3>Na2CO3
B.与质量分数相同的盐酸溶液反应放出气体的快慢:NaHCO3<Na2CO3
C.热稳定性:NaHCO3<Na2CO3
D.等质量的固体与足量盐酸反应放出CO2的质量Na2CO3>NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. HClO、H2CO3、HNO3、HClO4的酸性依次增强
B. 苹果酸![]() 含有1个手性碳原子
含有1个手性碳原子
C. HCl、NH3、C2H5OH均易溶于水的原因之一是与H2O分子均形成氢键
D. 以极性键结合的分子不一定是极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:
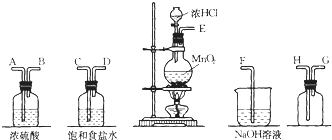
(1)连接上述仪器的正确顺序是:E接__,__接__,__接__,__接F。
(2)气体发生装置中进行的反应化学方程式是__;当0.5molMnO2参与反应时,生成的Cl2在标准状况下的体积约__。
(3)在装置中:①饱和食盐水的作用是__,②浓硫酸的作用是___。
(4)化学实验中检验是否有Cl2产生常用湿润的淀粉-KI试纸。如果有Cl2产生,可观察到的现象是___。
(5)写出尾气吸收装置中进行的反应的化学方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.熔融NaCl能导电,是因为通电时NaCl发生了电离
B.NaCl固体不导电,因为NaCl固体中无带电微粒
C.NH4NO3电离时产生了NH![]() 、NO
、NO![]() ,无金属离子,所以NH4NO3不是盐
,无金属离子,所以NH4NO3不是盐
D.NaHSO4在水溶液中电离生成了Na+、H+、SO![]() 三种离子
三种离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知破坏1 mol A—A键、1 mol B—B键、1 mol A—B键时分别需要吸收436 kJ、498 kJ、463 kJ的能量。反应2A2+B2![]() 2A2B的能量变化关系如图所示。下列说法中错误的是( )。
2A2B的能量变化关系如图所示。下列说法中错误的是( )。
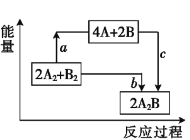
A. a=1370 kJB. b=482 kJ
C. 该反应是吸热反应D. 体系中A、B原子最活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知亚硝酸钠能发生如下反应:2NaNO2+ 4HI= 2NO + I2 + 2NaI + 2H2O
(1)用双线桥表示电子转移的方向与数目__________。
(2)若有1mol还原剂被氧化,则在此反应中发生转移的电子数目为_________。
II.已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O
(1)该反应中还原产物为__________。
(2)每生成2molCuI,有__________mol KI被IO3-氧化。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com