
【题目】下列说法不正确的是( )
A.一氧化碳的摩尔质量与6.02×1023个氮气分子的质量在数值上相等
B.6.02×1023个N2和6.02×1023个O2的质量比等于7︰8
C.3.2gO2所含的原子数目约为0.2×6.02×1023
D.常温、常压下,0.5×6.02×1023个二氧化碳分子质量是44g
科目:高中化学 来源: 题型:
【题目】含+6价铬的污水会污染环境,电镀厂产生的镀铜废水中往往含有一定量的![]() ,处理该废水常用还原沉淀法,具体流程如下:
,处理该废水常用还原沉淀法,具体流程如下:

(1)步骤①用稀硫酸调节pH,不选用盐酸的原因是______________________________。
(2)已知每消耗1mol Na2S2O3转移8mol e-,则加入Na2S2O3溶液时发生反应的离子方程式为:_________________________________________________________。
(3)已知Cr(OH)3的化学性质与Al(OH)3相似。步骤②加入NaOH溶液时要控制溶液的pH不能过高,是因为___________________________________________(用离子方程式表示)。
(4)下列溶液中可以代替上述流程中Na2S2O3溶液最佳的是__________(填选项序号);
A.FeSO4溶液 B.浓H2SO4C.Na2SO3溶液 D.酸性KMnO4溶液
(5)某厂废水中含1.50×10-3mol/L的![]() ,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Cr的化合价为+3,Fe的化合价依次为+3、+2)可变废为宝。欲使1 L该废水中的
,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Cr的化合价为+3,Fe的化合价依次为+3、+2)可变废为宝。欲使1 L该废水中的![]() 完全转化为Cr0.5Fe1.5FeO4,理论上需要加入__________gFeSO4·7H2O。(已知FeSO4·7H2O的摩尔质量为278g/mol)
完全转化为Cr0.5Fe1.5FeO4,理论上需要加入__________gFeSO4·7H2O。(已知FeSO4·7H2O的摩尔质量为278g/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77 kJmol-1
CH3OH(g) △H3=-90.77 kJmol-1
回答下列问题:
(1)反应Ⅱ的△H2=_________,若反应Ⅰ、Ⅱ、Ⅲ平衡常数分别为K1、K2、K3,则K2=________(用K1、K3表示)。
(2)反应Ⅲ自发进行条件是___________(填“较低温度”、“较高温度”或“任何温度”)。
(3)在一定条件下2 L恒容密闭容器中充入3 mol H2和1.5 mol CO2,仅发生反应Ⅰ,实验测得不同反应温度与体系中CO2的平衡转化率的关系,如下表所示。
温度(℃) | 500 | T |
CO2的平衡转化率 | 60℅ | 40℅ |
①T______500℃(填“>”、“<” 、“=”)。
②温度为500℃时,该反应10 min时达到平衡。用H2表示该反应的反应速率v(H2)=______________;该温度下,反应I的平衡常数K=______________L2/mol2
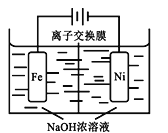
(4)由CO2制备甲醇还需要氢气。工业上用电解法制取Na2FeO4,同时获得氢气:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图所示。电解一段时间后,c(OH)降低的区域在__________ (填“阴极室”或“阳极室”)。该室发生的电极反应式为:___________________________。
FeO42+3H2↑,工作原理如图所示。电解一段时间后,c(OH)降低的区域在__________ (填“阴极室”或“阳极室”)。该室发生的电极反应式为:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2NO(g)+Br2(g)![]() 2NOBr(g) ΔH=-a kJ·mol1(a>0),其反应机理如下
2NOBr(g) ΔH=-a kJ·mol1(a>0),其反应机理如下
①NO(g)+Br2(g)![]() NOBr2(g) 快
NOBr2(g) 快
②NO(g)+NOBr2(g) ![]() 2NOBr(g) 慢
2NOBr(g) 慢
下列有关该反应的说法正确的是( )
A. 该反应的速率主要取决于①的快慢
B. NOBr2是该反应的催化剂
C. 增大Br2(g)浓度能增大活化分子百分数,加快反应速率
D. 正反应的活化能比逆反应的活化能小a kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,我国某物理研究所取得重大科技成果,研制出由18O所形成的单质气体。18O是一种稳定的同位素,称为重氧。下列有关说法不正确的是( )
A.1.8 g18O形成的气体的物质的量是0.05 mol
B.0.1 mol重氧水H218O所含的中子数约为6.02×l023个
C.0.2 mol18O2气体的体积约为4.48 L
D.18O2气体的摩尔质量为36 g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:
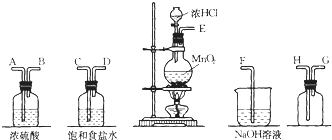
(1)连接上述仪器的正确顺序是:E接__,__接__,__接__,__接F。
(2)气体发生装置中进行的反应化学方程式是__;当0.5molMnO2参与反应时,生成的Cl2在标准状况下的体积约__。
(3)在装置中:①饱和食盐水的作用是__,②浓硫酸的作用是___。
(4)化学实验中检验是否有Cl2产生常用湿润的淀粉-KI试纸。如果有Cl2产生,可观察到的现象是___。
(5)写出尾气吸收装置中进行的反应的化学方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列反应:
①2H2O+Cl2+SO2=H2SO4+2HCl
②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
针对上述两个反应回答:
(1)用单线桥标出①中电子转移的方向和数目_______________________________;
(2)写出②的离子化学方程式_____________________________________________;
(3)Cl2、H2SO4和KMnO4的氧化性由强到弱的顺序为________________________;
(4)反应②中氯化氢表现出的性质是________。
a.还原性 b.酸性 c.氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铜为原料可制备应用广泛的氧化亚铜。
(1)向CuCl2溶液中通入SO2可得到CuCl沉淀,发生反应的化学方程式为:____。
(2)由CuCl水解再热分解可得到纳米Cu2O。CuCl水解为:CuCl(s)+H2O(l)![]() CuOH(s)+Cl-(aq)+H+(aq)。该反应的平衡常数K与此温度下KW、Ksp(CuOH)、Ksp(CuCl)的关系为K=___。
CuOH(s)+Cl-(aq)+H+(aq)。该反应的平衡常数K与此温度下KW、Ksp(CuOH)、Ksp(CuCl)的关系为K=___。
(3)用铜作阳极,钛片作阴极,电解一定浓度的NaCl和NaOH的混合溶液可得到Cu2O,阳极及其溶液中有关转化如图1所示。溶液中③、④二步总反应的离子方程式为:___。
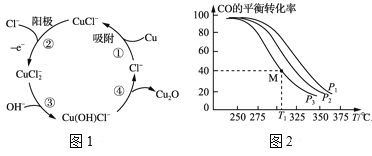
(4)Cu2O与ZnO组成的催化剂可用于工业上合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) ΔH=a kJ·mol-1。按n(H2)/n(CO)=2:1投料比将H2与CO充入V L恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图2所示。
CH3OH(g) ΔH=a kJ·mol-1。按n(H2)/n(CO)=2:1投料比将H2与CO充入V L恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图2所示。
①该反应的ΔH___0(填“<”或“>”),图中压强P1、P2、P3由大到小的关系是___。
②起始时,容器中c(H2)=0.20mol·L-1,c(CO)=0.10mol·L-1,在P3及T1℃下反应达到平衡,此时反应的平衡常数为___。(保留一位小数)
起始时,若容器中c(H2)=0.40mol·L-1,c(CO)=0.20mol·L-1,T1℃下反应达到平衡,CO的平衡转化率____。
A.大于40% B.小于40% C.等于40% D.等于80%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com