
【题目】W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为_____________
(2)W与Y 可形成化合物W2Y,该化合物的电子式为________________________。
(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为_________________________。Y的最高价氧化物是否满足8电子稳定结构______________(填是.否)
(4)比较Y、Z气态氢化物的稳定性由大到小的顺序是________________(用分子式表示)。
(5)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是
____________________________________________________。(用离子符号表示)。
【答案】OH-+Al(OH)3=AlO2-+2H2O Na+[![]() ]2-Na+ SO2+Cl2+2H2O=2HCl+H2SO4 否 HCl>H2S S2->Cl->Na+>Al3+
]2-Na+ SO2+Cl2+2H2O=2HCl+H2SO4 否 HCl>H2S S2->Cl->Na+>Al3+
【解析】
W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素,W、X各自的最高价氧化物对应的水化物可以两两反应,则X为铝元素,W为钠元素,W、X、Y、Z均为第三周期元素,W与Y可形成化合物W2Y,则Y为硫元素,Z的原子序数比Y大,所以Z为氯元素,据此答题。
(1)W、X各自的最高价氧化物对应的水化物分别为Al(OH)3、NaOH,反应的离子方程式为OH-+Al(OH)3=AlO2-+2H2O,故答案为:OH-+Al(OH)3=AlO2-+2H2O。
(2)W与Y可形成化合物Na2S,Na2S由钠离子和硫离子组成,电子式为Na+[![]() ]2-Na+,故答案为:Na+[
]2-Na+,故答案为:Na+[![]() ]2-Na+。
]2-Na+。
(3)二氧化硫通入氯水中,反应的化学方程式为SO2+Cl2+2H2O=2HCl+H2SO4,Y的最高价氧化物为SO3,SO3中,S原子的最外层电子为:6+6=12,O原子的最外层电子为:6+|-2|=8,不都满足8电子稳定结构,故答案为:SO2+Cl2+2H2O=2HCl+H2SO4;否。
(4)因为氯的非金属性强于硫,所以氯化氢的稳定性强于硫化氢,故答案为:HCl>H2S。
(5)电子层数越多,离子半径越大,电子层数相同时,核电荷数越多,离子半径越小,所以W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是:S2->Cl->Na+>Al3+,
故答案为:S2->Cl->Na+>Al3+。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】有下列几种有机物: ①CH3COOCH3 ②CH2=CHCH2Cl ③![]() ④CH2=CH-COOCH3 ⑤ CH2=CH-CHO
④CH2=CH-COOCH3 ⑤ CH2=CH-CHO
其中既能发生水解反应,又能发生加成反应的是( )
A. ①④B. ①③④C. ②⑤D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是( )
A. SO3+ H2O= H2SO4 B. NH4Cl ![]() NH3
NH3![]() +HCl
+HCl![]()
C. Fe+CuSO4= FeSO4+Cu D. NaOH+HNO3=NaNO3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的离子方程式:
(1)Zn和稀H2SO4反应: ______________________________________。
(2)CaCO3与稀HCl反应: __________________________________。
(3)CH3COOH与NaOH溶液的中和反应: _____________________。
(4)Ba(OH)2与CuSO4溶液反应: _____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式表达正确的是( )
A. 少量Fe与稀硝酸反应:Fe+2H+=Fe2++H2↑
B. Ca(OH)2溶液中加入足量NaHCO3溶液:Ca2++HCO3-+ OH-=CaCO3↓+H2O
C. 氯气溶于水:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
D. 铝片溶于NaOH溶液中:2Al+2OH-+2H2O=2AlO2-+3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一反应体系中有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。 已知该反应中H2O2只发生如下过程:H2O2→O2
(1)该反应中的还原剂是______________。(填化学式)
(2)该反应中,发生还原反应的过程是________→________。(填化学式)
(3)写出该反应的化学方程式,并用单线桥标出电子转移的方向和数目:____________________________________________________________。
(4)如反应转移了0.3 mol电子,则产生的气体在标准状况下体积为__________。
(5)反应8NH3+3Cl2=6NH4Cl+N2中,氧化剂与还原剂的物质的量之比是_________。
(6)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式:______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2是形成雾霾天气的原因之一。
(1)重型车辆常在排气管内“喷淋”尿素[CO(NH2)2]溶液,使NO2转化为无污染物质。采用“喷淋”时,该反应的活化能____(选填“增大”“减小”“不变”),写出该反应的化学方程式:____。(已知:CO(NH2)2中N呈-3价)
(2)以CO2与NH3为原料可合成化肥尿素。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-l59.5 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l) ΔH=-160.5 kJ·mol-1
③H2O(l)=H2O(g) ΔH=+44.0 kJ·mol-1
写出CO2与NH3合成尿素和气态水的热化学反应方程式______。
(3)恒温下将1.6molNH3和0.8molCO2放入容积为8L的恒容密闭容器中,反应生成NH2CO2NH4(s),下列各项能说明反应达到平衡状态的是______。
a.容器内气体压强保持不变 b.CO2与NH3的速率之比为1∶2
c.NH2CO2NH4(s)质量保持不变 d.容器内温度保持不变
该反应达到平衡时,测得CO2的物质的量浓度为0.05mol·L-1。则平衡时CO2的转化率α=____;若其他条件不变,移去少量NH2CO2NH4,CO2的转化率_____(选填“增大”“减小”“不变”)。
(4)为减少NO2排放,可将NO2转化为NO后通入如图所示装置,同时补充气体物质A使NO全部转化为NH4NO3,该装置中总化学反应方程式是_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究Na2O2与水的反应,实验如图:(已知:H2O2 ![]() H+ + HO2-、HO2-
H+ + HO2-、HO2- ![]() H+ + O22-)下列分析不正确的是
H+ + O22-)下列分析不正确的是

A. ①、⑤中产生的气体能使带火星的木条复燃
B. ①、④中均发生了氧化还原反应和复分解反应
C. ②、⑤中KMnO4与MnO2的作用不同,产生气体的量也不同
D. 通过③能比较酸性:HCl>H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表代表周期表中的几种短周期元素,下列说法中错误的是
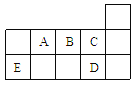
A. ED4分子中各原子均达8电子结构
B. AD3和ED4两分子的中心原子均为sp3杂化
C. A、B、C第一电离能的大小顺序为C>B>A
D. C、D气态氢化物稳定性强弱和沸点高低均为C>D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com