
【题目】(1)有BaCl2和KCl的混合溶液VL,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀,消耗amolH2SO4;另一份滴加AgNO3溶液,消耗bmolAgNO3使Cl-完全沉淀。原混合溶液中的K+的物质的量浓度为____mol·L-1。
(2)一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则与1molCr3+反应所需PbO2的物质的量为____mol;
(3)在一定条件下,实验室分别以过氧化氢、高锰酸钾、氯酸钾、过氧化钠为原料制取氧气,当制得同温同压下相同体积的氧气时,四个反应中转移的电子数之比为_____。
(4)自来水中的NO3-对人类健康产生危害。为了降低自来水中NO3-的浓度,某研究人员提出在碱性条件下用Al粉还原NO3-,产物是N2。发生的反应可表示如下,请完成方程式的配平:
___Al+___NO3-+___—___AlO2-+___N2↑+___H2O
(5)某化学反应的反应物和产物:KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O
①该反应的氧化产物是____。
②若该反应方程式中I2和KIO3的计量数分别是6和3,则生成1molI2时,转移电子的物质的量为___。
【答案】![]() 1.5 1∶2∶2∶1 10 6 4OH 10 3 2 I2、KIO3 5mol
1.5 1∶2∶2∶1 10 6 4OH 10 3 2 I2、KIO3 5mol
【解析】
(1)根据SO42-+Ba2+═BaSO4↓计算溶液中的Ba2+离子的物质的量,根据Ag++Cl-=AgCl↓算Cl-的物质的量,再根据c=![]() 计算Ba2+离子、Cl-离子浓度,利用电荷守恒有2c(Ba2+)+c(K+)=c(Cl-),据此计算原溶液中的K+浓度;
计算Ba2+离子、Cl-离子浓度,利用电荷守恒有2c(Ba2+)+c(K+)=c(Cl-),据此计算原溶液中的K+浓度;
(2)在一定条件下,PbO2与溶液中Cr3+反应,产物是Cr2O72-和Pb2+,根据电子守恒计算;
(3)用高锰酸钾、氯酸钾制氧气,反应过程中O由-2价转化为0价,而用过氧化氢和过氧化钠制氧气,O则由-1价转化为0价。现要制得相同的O2,所以用过氧化氢和过氧化钠制氧气的反应中转移的电子数只有用高锰酸钾、氯酸钾制取的反应中转移的电子数的一半;
(4)反应中Al→AlO2-,Al元素化合价由0价升高为+3价,共升高3价,NO3-→N2↑,氮元素化合价由+5价降低为0价,共降低10价,根据化合价升降守恒分析配平;
(5)反应KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O中,Mn元素化合价降低,由+7价降低到+2价,被还原,KMnO4为氧化剂,I元素化合价升高,由-1价升高到0价和+5价,KI为还原剂,则氧化产物为I2和KIO3,据此分析解答。
(1)BaCl2和NaCl的混合溶液V L,将它均分成两份。一份滴加稀硫酸,使Ba2+完全沉淀,消耗a molH2SO4,根据SO42-+Ba2+═BaSO4↓,c(Ba2+)=![]() =
=![]() mol/L,另一份滴加AgNO3溶液,使Cl-完全沉淀,反应中消耗bmolAgNO3,根据Ag++Cl-=AgCl↓,c(Cl-)=
mol/L,另一份滴加AgNO3溶液,使Cl-完全沉淀,反应中消耗bmolAgNO3,根据Ag++Cl-=AgCl↓,c(Cl-)=![]() =
=![]() mol/L,溶液不显电性,由电荷守恒可知,c(K+)+
mol/L,溶液不显电性,由电荷守恒可知,c(K+)+![]() mol/L×2=
mol/L×2=![]() mol/L,解得c(K+)=
mol/L,解得c(K+)=![]() mol/L,故答案为:
mol/L,故答案为:![]() ;
;
(2)在一定条件下,PbO2与溶液中Cr3+反应,产物是Cr2O72-和Pb2+,反应中Cr的价态升高了3价,pb的化合价降低2价,根据化合价升降守恒,所以与1mol Cr3+反应所需PbO2的物质的量为1.5mol,故答案为:1.5;
(3)用高锰酸钾、氯酸钾制氧气,反应过程中O由-2价转化为0价,如生成1mol O2,需转移4mol电子,而用过氧化氢和过氧化钠制氧气,O则由-1价转化为0价,如生成1mol O2,需转移2mol电子,当制得同温同压下相同体积的氧气时,四个反应中转移的电子数之比为1∶2∶2∶1,故答案为:1∶2∶2∶1;
(4)反应中Al→AlO2-,Al元素化合价由0价升高为+3价,共升高3价,NO3-→N2↑,氮元素化合价由+5价降低为0价,共降低10价,化合价升降的最小公倍数为30,故Al的系数为10,N2系数为3,由氮元素守恒可知系数为6,由Al元素守恒可知系数为10,由电荷守恒可知系数为,由H元素守恒可知系数为,故配平后离子方程式为:10Al+6NO3-+4OH-=10AlO2-+3N2↑+2H2O,故答案为:10;6;4OH-;10;3;2;
(5)①反应中Mn元素化合价降低,被还原,I元素化合价由-1价分别变化为0价、+5价,则I2、KIO3 为氧化产物,故答案为:I2、KIO3;
②若该反应方程式中I2和KIO3的计量数分别是6和3,则生成1molI2时,同时生成0.5molKIO3,则I元素失去电子的数目为2×1(1-0)mol+0.5×[5-(-1)]mol=5mol,即反应过程中转移电子的物质的量为5mol,故答案为:5mol。


科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)具有复合官能团的复杂有机物,其官能团具有各自的独立性,在不同条件下所具有的化学性质可分别从各官能团讨论。如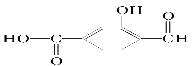 具有三种官能团:______、__________和__________(填官能团的名称),所以这个化合物可看作______类,______类和______类。
具有三种官能团:______、__________和__________(填官能团的名称),所以这个化合物可看作______类,______类和______类。
(2)羟基的电子式是___________________________。
(3)(CH3CH2)2C(CH3)2的名称为_________________________。
(4)2-甲基-1,3-丁二烯的键线式___________________________。
(5)![]() 该有机物发生加聚反应后,所得产物的结构简为______。
该有机物发生加聚反应后,所得产物的结构简为______。
(6)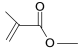 分子式为_______________________结构简式为______________________。
分子式为_______________________结构简式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅及其化合物在材料领域中应用广泛。回答下列问题:
(1)硅单质有晶体硅和无定形硅两种,区别晶体硅和无定形硅的科学方法是___________
(2)基态硅的价电子排布式为_________,其核外电子的运动状态有_____种。
(3)CCl4和SiCl4常温下均呈液态,SiCl4熔沸点较高的原因为________CCl4不水解,但SiCl4遇水即强烈水解,则SiCl4水解的化学方程式为__________。
(4)SiF4的热稳定性比SiCl4强的原因是 ____。
(5)碳化硅(SiC)的结构与金刚石类似,碳化硅的硬度仅次于金刚石,其晶胞结构如图所示。则Si原子的配位数为_______,若晶体的密度为ρg/cm3![]() ,阿伏伽德罗常数为NA,则距离最近的Si原子与C原子之间的距离为_______________cm。(用ρ和NA的式子表示)
,阿伏伽德罗常数为NA,则距离最近的Si原子与C原子之间的距离为_______________cm。(用ρ和NA的式子表示) ![]()
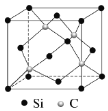
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行有关铜、硝酸、硫酸化学性质的实验,实验过程如图所示:
实验1 | 实验2 |
|
|
①、③中溶液呈蓝色,试管口有红棕色气体产生 | ③中溶液呈蓝色,试管口有红棕色气体产生 |
下列说法正确的是
A. 稀硝酸一定被还原为NO2
B. 实验1-②中溶液存在:c(Cu2+) + c(H+) =c(NO3-) + c(OH-)
C. 由上述实验得出结论:常温下,Cu既可与稀硝酸反应,也可与稀硫酸反应
D. 实验1-③、实验2-③中反应的离子方程式:3Cu+2NO3-+8H+ =3Cu2++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究Na2O2与水的反应,实验如图:(已知:H2O2 ![]() H+ + HO2-、HO2-
H+ + HO2-、HO2- ![]() H+ + O22-)下列分析不正确的是
H+ + O22-)下列分析不正确的是

A. ①、⑤中产生的气体能使带火星的木条复燃
B. ①、④中均发生了氧化还原反应和复分解反应
C. ②、⑤中KMnO4与MnO2的作用不同,产生气体的量也不同
D. 通过③能比较酸性:HCl>H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在KNO3固体样品中含有少量的KCl、BaCl2杂质,为了提纯KNO3并分离得到BaCl2,进行如下实验操作:
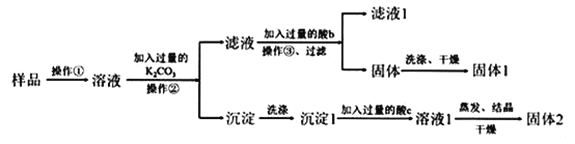
(1)加入过量K2CO3所发生反应的离子方程式为____;
(2)结合图中各物质的溶解度曲线可知操作③的名称是____;
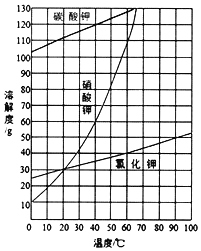
(3)有人认为操作③之前无需加入过量的酸b,也能达到实验目的,你认为该观点是否正确?并做出解释___。
(4)用制得的KNO3固体配制200mL0.2mol/LKNO3溶液。
①本实验用到的仪器有天平、药匙、玻璃棒、烧杯、量筒、还有___、___;
②下列情况会使所配制的KNO3 溶液的浓度偏高的是____(填字母)。
A.没有洗涤烧杯和玻璃棒
B.容量瓶不干燥,含有少量蒸馏水
C.定容时仰视刻度线
D.定容时俯视刻度线
E.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述正确的是
A. 按上述流程,试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①过滤后所得沉淀为氧化铁
C. 图中所有的转化反应都不是氧化还原反应
D. 反应②的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
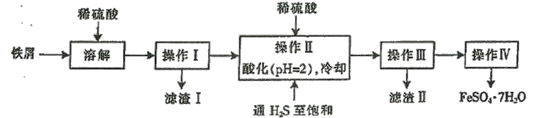
已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6,FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。根据以上流程图,下列说法不正确的是
A.操作I所得滤液中不含有Fe3+
B.操作Ⅱ中用硫酸酸化至pH=2的主要目的是抑制Fe2+的水解
C.操作Ⅱ中,通入H2S至饱和的目的是使Sn2+转化为SnS沉淀并防止Fe2+被氧化。
D.操作Ⅳ中所得的晶体最后用乙醇洗去晶体表面附着的水分。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某喜温植物幼苗在低温锻炼(10 ℃、6天)后,接着进行冷胁迫(2℃、12 h),其细胞内超氧化物歧化酶 (SOD,该酶能减缓植株的衰老)活性的动态变化图如下。下列相关分析错误的是
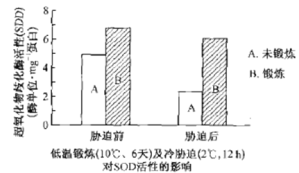
A.该实验目的为探究低温锻炼是否能提高植物抗寒能力
B.未锻炼组冷胁迫后SOD活性降低是由于其空间结构发生了改变
C.无论是否锻炼胁迫后SOD降低化学反应活化能的能力均降低
D.低温锻炼能提高SOD活性且其在冷胁迫后SOD活性相对较稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com