
【题目】在KNO3固体样品中含有少量的KCl、BaCl2杂质,为了提纯KNO3并分离得到BaCl2,进行如下实验操作:
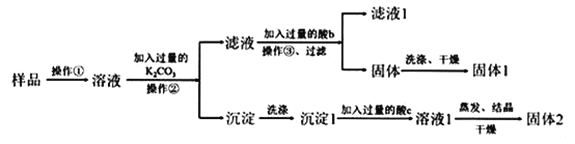
(1)加入过量K2CO3所发生反应的离子方程式为____;
(2)结合图中各物质的溶解度曲线可知操作③的名称是____;
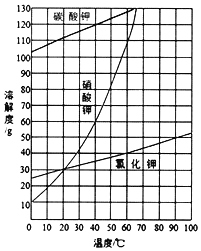
(3)有人认为操作③之前无需加入过量的酸b,也能达到实验目的,你认为该观点是否正确?并做出解释___。
(4)用制得的KNO3固体配制200mL0.2mol/LKNO3溶液。
①本实验用到的仪器有天平、药匙、玻璃棒、烧杯、量筒、还有___、___;
②下列情况会使所配制的KNO3 溶液的浓度偏高的是____(填字母)。
A.没有洗涤烧杯和玻璃棒
B.容量瓶不干燥,含有少量蒸馏水
C.定容时仰视刻度线
D.定容时俯视刻度线
E.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
【答案】CO32-+Ba2+=BaCO3↓ 蒸发浓缩、冷却结晶 正确,由于硝酸钾的溶解度随温度降低急剧下降,因此有大量硝酸钾晶体析出,而碳酸钾溶解度很大,因而不会结晶析出 胶头滴管 250mL容量瓶 D
【解析】
样品溶解后加入过量K2CO3溶液,生成碳酸钡沉淀和氯化钾,过滤得到碳酸钡沉淀经过洗涤、再加过量的c酸溶解,根据实验目的,c酸为盐酸,反应后得到氯化钡溶液,经蒸发结晶干燥可得到固体2为氯化钡固体;由于K2CO3过量,所以滤液中的物质有KNO3、KCl和K2CO3,因此要得到纯净的KNO3就需要除去K2CO3,所以加入过量的酸b为稀硝酸最合适,K2CO3和稀硝酸生成KNO3、水和二氧化碳,所得溶液中主要为KNO3和KCl,利用溶解度随温度变化不同,操作③可以采用蒸发浓缩、冷却结晶,析出KNO3晶体,过滤、洗涤、干燥得到固体1为KNO3,据此分析解答(1)~(3);
(4)①配制200mL0.2molL-1 KNO3,应选择250mL容量瓶;
②根据c=![]() 分析操作对溶质的物质的量或对溶液的体积的影响判断。
分析操作对溶质的物质的量或对溶液的体积的影响判断。
(1)加入过量K2CO3所发生反应的化学方程式为 BaCl2+K2CO3=BaCO3↓+2KCl,反应的离子方程式为:CO32-+Ba2+=BaCO3↓,故答案为:CO32-+Ba2+=BaCO3↓;
(2)因为硝酸钾溶解度随温度变化很大,而氯化钾溶解度随温度变化很小,所以要析出硝酸钾可以采用蒸发浓缩、冷却结晶的方法,则操作③的名称是蒸发浓缩、冷却结晶,故答案为:蒸发浓缩;冷却结晶;
(3)根据溶解度曲线,由于硝酸钾的溶解度随温度降低急剧下降,因此冷却结晶有大量硝酸钾晶体析出,而碳酸钾溶解度很大,因而不会结晶析出,所以操作③之前无需加入过量的盐酸除碳酸钾;故答案为:正确,由于硝酸钾的溶解度随温度降低急剧下降,因此有大量硝酸钾晶体析出,而碳酸钾溶解度很大,因而不会结晶析出;
(4)①配制200mL0.2molL-1 KNO3,应选择250mL容量瓶,所以本实验用到的仪器有天平、药匙、玻璃棒、烧杯、胶头滴管、量筒、还有250mL容量瓶,故答案为:胶头滴管;250mL容量瓶;
②A.没有洗涤烧杯和玻璃棒,导致溶质部分损耗,溶液浓度偏低,故A不选;
B.容量瓶不干燥,含有少量蒸馏水,对溶液的浓度无影响,故B不选;
C.仰视观察液面与容量瓶刻度线,导致溶液体积偏大,溶液浓度偏低,故C不选; D.俯视观察液面与容量瓶刻度线,导致溶液体积偏小,溶液浓度偏高,故D选;E.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线,溶液的体积偏大,溶液浓度偏低,故E不选;
故答案为:D。


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】(1)标准状况下:① 0.3mol氨气 ②6.02×1022个CO2分子 ③7.3gHCl ④ 0.2molCH4 。其中体积最大的是______;密度最大的是_____;质量最大的是_____。(填序号)
(2)相同质量的SO2与SO3,其物质的量之比为_________,氧元素的质量之比为_________,原子总数之比为____________。
(3)100mL 1 mol·L-1Al2(SO4)3溶液中含SO42-离子______个,含Al3+离子______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度和压强下,在2 L的密闭容器中合成氨气:N2(g)+3H2(g)![]() 2NH3(g) 。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。下列说法错误的是:
2NH3(g) 。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。下列说法错误的是:
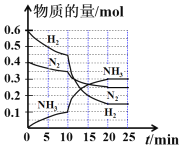
A. 0~10 min内,以NH3表示的平均反应速率为0.005 mol L-1 min-1
B. 10~20 min内,NH3浓度变化的原因可能是加入催化剂或缩小容器体积
C. 该反应在20 min时达到化学平衡状态
D. N2的平衡转化率与H2平衡转化率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作、现象和结论都正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向BaCl2溶液中通入CO2 | 产生白色沉淀 | 白色沉淀为BaCO3 |
B | 向 NaHCO3溶液中先加入CaCl2溶液,再加入NaOH溶液 | 产生白色沉淀 | 白色沉淀为CaCO3 |
C | 向某溶液加入NaOH溶液,用湿润的红色石蕊试纸检验产生的气体 | 湿润的红色石蕊试纸未变蓝 | 该溶液中一定不含有 |
D | 向某溶液中先加入HNO3溶液,再加入BaCl2溶液 | 产生白色沉淀 | 该溶液中一定含有 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有BaCl2和KCl的混合溶液VL,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀,消耗amolH2SO4;另一份滴加AgNO3溶液,消耗bmolAgNO3使Cl-完全沉淀。原混合溶液中的K+的物质的量浓度为____mol·L-1。
(2)一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则与1molCr3+反应所需PbO2的物质的量为____mol;
(3)在一定条件下,实验室分别以过氧化氢、高锰酸钾、氯酸钾、过氧化钠为原料制取氧气,当制得同温同压下相同体积的氧气时,四个反应中转移的电子数之比为_____。
(4)自来水中的NO3-对人类健康产生危害。为了降低自来水中NO3-的浓度,某研究人员提出在碱性条件下用Al粉还原NO3-,产物是N2。发生的反应可表示如下,请完成方程式的配平:
___Al+___NO3-+___—___AlO2-+___N2↑+___H2O
(5)某化学反应的反应物和产物:KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O
①该反应的氧化产物是____。
②若该反应方程式中I2和KIO3的计量数分别是6和3,则生成1molI2时,转移电子的物质的量为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有Na+、K+、NH4+、Ca2+、Cu2+、SO42-、SO32-、Cl-、Br-、CO32-中的若干种,离子浓度都为0.1 mol·L-1。往该溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。某同学另取少量原溶液,设计并完成如右实验:则下列关于原溶液的判断正确的是( )

A.若步骤中Ba(NO3)2和HNO3的混合溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响
B.无法确定原溶液中是否存在Cl-
C.肯定存在的离子是SO32-、Br-,是否存在Na+、K+需要通过焰色反应来确定
D.肯定不存在的离子是Ca2+、Cu2+、SO42-、CO32-,是否含NH4+另需实验验证
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表是元素周期表的一部分。
H | He | ||||||
Li | Be | B | C | N | O | F | Ne |
Na | Mg | Al | Si | P | S | Cl | Ar |
请回答下列问题。
(1)非金属性最强的元素名称为___________,它位于元素周期表中的位置___________。
(2)硅元素的原子结构示意图是____________,其最高价氧化物是____________(填“酸性”或“碱性”)氧化物。
(3)硼酸(H3BO3)的酸性_________(填“>” 或“<”)碳酸(H2CO3)的酸性,说明你判断的理由:__________________________。
(4)NH3的电子式为________________,它属于____________(填“离子”或“共价”)化合物。NH3的还原性_________(填“>” 或“<”)PH3的还原性。
(5)第三周期元素的最高价氧化物对应的水化物中,有一种物质既能与强酸反应又能与强碱反应,写出这种物质跟氢氧化钠溶液反应的化学方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙腈主要用于有机合成及生产医药,农药的中间体,对环境有危害。常温常压下,苯乙腈水解一般需加入酸碱催化剂。但研究人员发现,在近临界水(指温度在523~623K之间的压缩液态水)中,不加任何催化剂的情况下,苯乙腈就能发生水解反应生成苯乙酞胺:
C6H5CH2CN(l)+H2O(l)![]() C6H5CH2CONH2(l) △H
C6H5CH2CONH2(l) △H
(苯乙腈) (苯乙酰胺)
请回答下列问题:
(1)己知近临界水中,水的离子积常数为10-10,则此条件下,pH=7的NaAc溶液中由水电离的c(H+)=________ mol·L-1。该反应不加任何催化剂就能发生的主要原因是___________。
(2)研究反应的平衡常数(记作lgK)与温度(T)的关系,得到如图1所示的关系,判断该反应的△H__________0(填“>”“<”或“=”)。
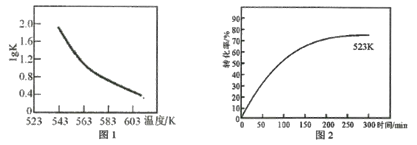
(3)图2表示其他条件不变时,温度和时间对苯乙腈转化率的影响曲线图(不完整)。若图中曲线对应的温度为523K,请你在原图中作出温度为583K的影响曲线。___________。
(4)下列哪种仪器可用于分析水解反应过程中苯乙腈浓度的变化_________(填编号)。
A.元素分析仪 B.核磁共振仪 C.原子吸收光谱仪 D.分光光度计
(5)科学家还在近临界水中分别添加CO2、NH3,研究后得到了如下的图示:
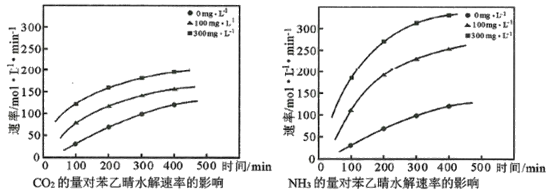
从中你可以得出什么结论(至少写出2点___________。
(6)水的用途很广,可利用太阳能光伏电池电解水制高纯氢,工作示意图如图。通过控制开关连接K1或K2,可交替得到H2和O2。
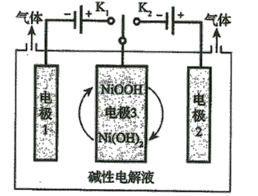
①制H2时,连接______________,可得H2。
②改变开关连接方式,产生O2的电极反应式__________________________。
③选用NiOOH、Ni(OH)2作为电极3材料的优点(请结合电极反应式进行阐述)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式正确的是( )
A. 氯化铝溶液与过量的氨水反应:Al3++4NH3·H2O===AlO![]() +4NH
+4NH![]() +2H2O
+2H2O
B. 小苏打溶液中加入过量的澄清石灰水:Ca2++2OH-+2HCO![]() ===CaCO3↓+ CO
===CaCO3↓+ CO![]() +2H2O
+2H2O
C. 纯碱溶液中滴加少量盐酸:CO32-+H+===HCO![]()
D. 用FeCl3溶液腐蚀铜电路板:Fe3++ Cu === Fe2++ Cu2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com