
【题目】(1)标准状况下:① 0.3mol氨气 ②6.02×1022个CO2分子 ③7.3gHCl ④ 0.2molCH4 。其中体积最大的是______;密度最大的是_____;质量最大的是_____。(填序号)
(2)相同质量的SO2与SO3,其物质的量之比为_________,氧元素的质量之比为_________,原子总数之比为____________。
(3)100mL 1 mol·L-1Al2(SO4)3溶液中含SO42-离子______个,含Al3+离子______mol。
【答案】① ② ③ 5:4 5:6 15:16 1.806×1023 (或0.3NA) 0.2;
【解析】
(1)根据n=![]() 计算CO2分子的物质的量,根据n=
计算CO2分子的物质的量,根据n=![]() 计算HCl的物质的量,根据m=nM计算氨气、二氧化碳、甲烷的质量,相同条件下,体积之比等于物质的量之比,据此判断体积大小;相同条件下,密度之比等于相对分子质量之比,据此判断密度大小;根据计算的氨气、二氧化碳、甲烷的质量,据此判断质量大小;
计算HCl的物质的量,根据m=nM计算氨气、二氧化碳、甲烷的质量,相同条件下,体积之比等于物质的量之比,据此判断体积大小;相同条件下,密度之比等于相对分子质量之比,据此判断密度大小;根据计算的氨气、二氧化碳、甲烷的质量,据此判断质量大小;
(2)根据n=![]() 可知,相同质量的SO2与SO3,其物质的量之比与摩尔质量成反比,根据SO2与SO3分子中含有O原子数目,结合SO2与SO3的物质的量之比,利用m=nM计算判断氧元素的质量之比等于氧原子数目之比;根据SO2与SO3分子中含有原子数目,结合SO2与SO3的物质的量之比,判断原子的物质的量之比;
可知,相同质量的SO2与SO3,其物质的量之比与摩尔质量成反比,根据SO2与SO3分子中含有O原子数目,结合SO2与SO3的物质的量之比,利用m=nM计算判断氧元素的质量之比等于氧原子数目之比;根据SO2与SO3分子中含有原子数目,结合SO2与SO3的物质的量之比,判断原子的物质的量之比;
(3)1molAl2(SO4)3中含铝离子2mol,硫酸根离子的物质的量为3mol,则100mL 1 mol·L-1Al2(SO4)3溶液中的物质的量为0.1L×1 mol·L-1=0.1mol,则得到SO42-离子个数,含Al3+离子的物质的量。
(1)①0.3mol氨气,质量为0.3mol×17g/mol=5.1g,②6.02×1022个CO2分子,物质的量为![]() =0.1mol,质量为0.1mol×44g/mol=4.4g,③7.3gHCl,其物质的量为
=0.1mol,质量为0.1mol×44g/mol=4.4g,③7.3gHCl,其物质的量为![]() =0.2mol,④0.2molCH4,质量为0.2mol×16g/mol=3.2g,相同条件下,体积之比等于物质的量之比,故体积最大的是:①0.3mol氨气;相同条件下,密度之比等于相对分子质量之比,CO2的相对分子质量最大,故密度最大的是:②CO2分子;由上述计算可知,质量最大的是:③7.3gHCl,
=0.2mol,④0.2molCH4,质量为0.2mol×16g/mol=3.2g,相同条件下,体积之比等于物质的量之比,故体积最大的是:①0.3mol氨气;相同条件下,密度之比等于相对分子质量之比,CO2的相对分子质量最大,故密度最大的是:②CO2分子;由上述计算可知,质量最大的是:③7.3gHCl,
故答案为①;②;③;
(2)根据n=![]() 可知,物质的量之比与摩尔质量成反比,故相同质量的SO2与SO3的物质的量之比为80g/mol:64g/mol=5:4,相同质量SO2与SO3分子中含有的氧元素的质量之比为(5×2):(4×3)=5:6,相同质量SO2与SO3分子中含有原子数目之比为(5×3):(4×4)=15:16,
可知,物质的量之比与摩尔质量成反比,故相同质量的SO2与SO3的物质的量之比为80g/mol:64g/mol=5:4,相同质量SO2与SO3分子中含有的氧元素的质量之比为(5×2):(4×3)=5:6,相同质量SO2与SO3分子中含有原子数目之比为(5×3):(4×4)=15:16,
故答案为5:4;5:6;15:16。
(3)1molAl2(SO4)3中含铝离子2mol,硫酸根离子的物质的量为3mol,则100mL 1 mol·L-1Al2(SO4)3溶液中的物质的量为0.1L×1 mol·L-1=0.1mol,则得到SO42-离子个数为0.1×3NA=0.3 NA,含Al3+离子的物质的量0.1mol×2=0.2mol,
故答案为1.806×1023 (或0.3NA);0.2。


科目:高中化学 来源: 题型:
【题目】元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子结构示意图为___。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是___(填下列字母序号)。
a.Cl2、Br2、I2的熔点 b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d.HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液![]() NaClO3溶液
NaClO3溶液![]() KClO3晶体
KClO3晶体
①完成Ⅰ中反应的总化学方程式:_NaCl+________H2O=________NaClO3+__________。
②Ⅱ中转化的基本反应类型是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及硼的化合物有着广泛的用途。请回答下列问题:
(1) 硼酸(H3BO3)为一元弱酸,硼酸中B的化合价为________。
(2) 已知:H3BO3的电离常数Ka=5.8×1010,H2CO3的电离常数掏Ka1=4.4×107、Ka2=4.7×1011,向饱和硼酸溶液中滴加0.1 mol·L1 Na2CO3溶液,写出发生反应的离子方程式________。
(3) 以硼酸为原料可制备重要还原剂NaBH4。NaBH4与BF3在50℃~70℃反应生成NaBF4和乙硼烷(B2H6),该反应的化学方程式是________。
(4) B2H6是强还原剂,氢元素的化合价与NaH中的氢相同。B2H6与水反应生成H3BO3和H2,若有0.1 mol电子转移时,则产生H2在标准状况下的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列五组物质:A、 O2和O3 B 、![]() Cl和
Cl和![]() Cl C 、CH4 与C7H16 D、CH3CH2CH2CH3 与
Cl C 、CH4 与C7H16 D、CH3CH2CH2CH3 与 E、
E、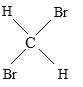 与
与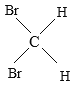
(1)______组两种物质互为同位素;
(2)______组两种物质互为同素异形体;
(3)______组两种物质互为同系物;
(4)______组两种物质互为同分异构体;
(5)______组两种物质实为同一物质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)具有复合官能团的复杂有机物,其官能团具有各自的独立性,在不同条件下所具有的化学性质可分别从各官能团讨论。如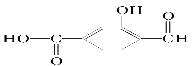 具有三种官能团:______、__________和__________(填官能团的名称),所以这个化合物可看作______类,______类和______类。
具有三种官能团:______、__________和__________(填官能团的名称),所以这个化合物可看作______类,______类和______类。
(2)羟基的电子式是___________________________。
(3)(CH3CH2)2C(CH3)2的名称为_________________________。
(4)2-甲基-1,3-丁二烯的键线式___________________________。
(5)![]() 该有机物发生加聚反应后,所得产物的结构简为______。
该有机物发生加聚反应后,所得产物的结构简为______。
(6)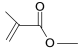 分子式为_______________________结构简式为______________________。
分子式为_______________________结构简式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁是一种重要金属,号称国防金属。某设计小组利用硼镁矿制备镁和硼的流程如下:
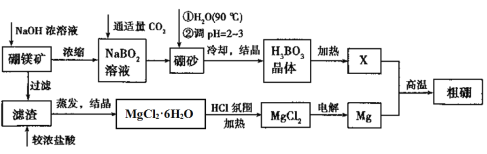
已知:硼镁矿的主要成分Mg2B2O5·H2O,硼砂的化学式为Na2B4O7·10H2O,回答下列问题:
(1)Mg2B2O5·H2O中B的化合价为________。在90℃的热水中,加入稀硫酸调节pH=2~3生成硼酸(H3BO3),反应的离子方程式为__________。
(2)硼的化合物种类繁多,NaBH4是有机合成中常见的还原剂,NaBH4的电子式为______。
(3)将MgCl2·6H2O置于HCl氛围中加热的目的是_____,Mg与X在高温下反应的化学方程式为________。
(4)若向硼镁矿中加入0.1 mol/L盐酸溶液,充分反应后测得溶液的pH=2时,溶液中c(Mg2+)为__________________________________(忽略溶液体积的变化)。
(5)电解熔融的无水氯化镁所得的镁蒸汽在特定的环境里冷却后即为固体镁,下列物质中可以作镁蒸汽的冷却剂的是_________(填字母序号)
A氦气 B氮气
C水蒸气 D二氧化碳气体 E氯气
(6)Mg-H2O2是一种以海水为电解质(加入一定量的酸)的新型电池。该电池的负极材料为_____,正极的电极反应为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数的值。下列说法正确的是( )
A.一定条件下,3molH2和1molN2充分反应后,可得2NA个NH3分子
B.室温下,1LpH=1的HCl溶液中,由水电离的H+数目为0.1NA
C.0.1mol金属Na在空气中完全氧化生成Na2O和Na2O2,转移的电子数为0.1NA
D.1mol/L的NaCN溶液中含CN-和HCN的数目之和为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AG表示溶液酸度:![]() 。常温下,用0.1mol/L的NaOH溶液滴定25 ml 0.1mol/L的CH3COOH滴定结果如图所示,下列分析正确的是()
。常温下,用0.1mol/L的NaOH溶液滴定25 ml 0.1mol/L的CH3COOH滴定结果如图所示,下列分析正确的是()
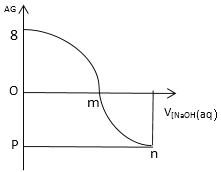
A.0.1mol/L的 CH3COOH溶液的pH=3
B.m点加入NaOH的体积为25mL
C.若pH=7,则溶液中水电离的c(OH-)=1.0×10-3.5 mol/L
D.随着NaOH溶液滴入,溶液中水的电离程度逐渐增大,m点最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在KNO3固体样品中含有少量的KCl、BaCl2杂质,为了提纯KNO3并分离得到BaCl2,进行如下实验操作:
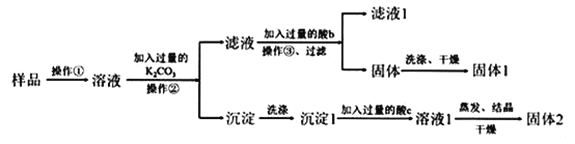
(1)加入过量K2CO3所发生反应的离子方程式为____;
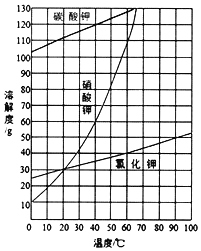
(2)结合图中各物质的溶解度曲线可知操作③的名称是____;
(3)有人认为操作③之前无需加入过量的酸b,也能达到实验目的,你认为该观点是否正确?并做出解释___。
(4)用制得的KNO3固体配制200mL0.2mol/LKNO3溶液。
①本实验用到的仪器有天平、药匙、玻璃棒、烧杯、量筒、还有___、___;
②下列情况会使所配制的KNO3 溶液的浓度偏高的是____(填字母)。
A.没有洗涤烧杯和玻璃棒
B.容量瓶不干燥,含有少量蒸馏水
C.定容时仰视刻度线
D.定容时俯视刻度线
E.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com