
【题目】NA为阿伏伽德罗常数的值。下列说法正确的是( )
A.一定条件下,3molH2和1molN2充分反应后,可得2NA个NH3分子
B.室温下,1LpH=1的HCl溶液中,由水电离的H+数目为0.1NA
C.0.1mol金属Na在空气中完全氧化生成Na2O和Na2O2,转移的电子数为0.1NA
D.1mol/L的NaCN溶液中含CN-和HCN的数目之和为NA
科目:高中化学 来源: 题型:
【题目】现用金属钠和空气制备纯度较高的Na2O2,可利用的装置如下:

请回答下列问题:
(1)若规定气体的流动方向为从左到右,则组合实验装置时各仪器的连接顺序是:空气→Ⅳ→________→________→________(填“Ⅰ、Ⅱ、Ⅲ”,仪器不能重复使用)。
(2)装置Ⅳ中盛放的药品是___________,其作用是____________________。
(3)装置Ⅱ的作用是_________________________________________。
(4)加热装置Ⅰ时发生反应的化学方程式为___________________________。
(5)下列对于过氧化钠的叙述中,正确的是___________。
A.过氧化钠能与酸反应生成盐和水,所以过氧化钠是碱性氧化物
B.将过量Na2O2投入紫色石蕊试液中,溶液变蓝
C.过氧化钠与水反应时,过氧化钠是氧化剂,水是还原剂
D.过氧化钠与二氧化碳反应时,过氧化钠既是氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2通入BaCl2溶液中并不产生沉淀,而通入另一种气体后可以产生白色沉淀。则图中右侧Y形管中放置的药品组合不符合要求的是(必要时可以加热)( )
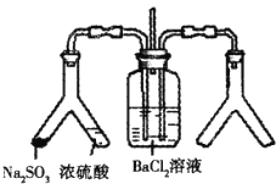
A. Cu和浓硝酸 B. CaO和浓氨水
C. 大理石和稀盐酸 D. 高锰酸钾溶液和浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标准状况下:① 0.3mol氨气 ②6.02×1022个CO2分子 ③7.3gHCl ④ 0.2molCH4 。其中体积最大的是______;密度最大的是_____;质量最大的是_____。(填序号)
(2)相同质量的SO2与SO3,其物质的量之比为_________,氧元素的质量之比为_________,原子总数之比为____________。
(3)100mL 1 mol·L-1Al2(SO4)3溶液中含SO42-离子______个,含Al3+离子______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3 mol A和2.5 mol B混合于2 L密闭容器中,发生的反应如下:3A(g)+B(g) ![]() xC(g)+2D(g),5 min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.1 mol/(L·min),下列结论正确的是
xC(g)+2D(g),5 min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.1 mol/(L·min),下列结论正确的是
A. A的平均反应速率为 0.1 mol/(L·min)
B. 平衡时,C的浓度为 0.125 mol/L
C. 平衡时,B的转化率为 20%
D. 平衡时,容器内压强为原来的 0.8 倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:稀Na3AsO3溶液、稀碘水和稀NaOH溶液混合,发生如下反应:AsO33-(aq)+I2(aq)+2OH-(aq)![]() AsO43-(aq)+2I-(aq)+H2O(l),反应一段时间后测得c(AsO43-)为amol·L-1。下列说法能判断反应达到平衡状态的是
AsO43-(aq)+2I-(aq)+H2O(l),反应一段时间后测得c(AsO43-)为amol·L-1。下列说法能判断反应达到平衡状态的是
A.c(I-)=2a mol·L—1
B.v (I-)=2v(AsO43-)
C.c(AsO43-)/c(I-)不再变化
D.溶液的pH不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解1.0 L c(Cl-)=3.0 mol/L的CuCl2、NaCl混合溶液,一段时间后,两极均收集到56.0 L的气体(标准状况下)。下列说法正确的是( )
A.阳极只收集到Cl2
B.电解前溶液呈弱酸性,电解结束后,溶液的酸性增强
C.整个过程中共转移电子5 mol
D.原混合溶液中c(Cu2+)=1.0 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度和压强下,在2 L的密闭容器中合成氨气:N2(g)+3H2(g)![]() 2NH3(g) 。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。下列说法错误的是:
2NH3(g) 。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。下列说法错误的是:
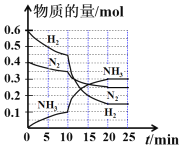
A. 0~10 min内,以NH3表示的平均反应速率为0.005 mol L-1 min-1
B. 10~20 min内,NH3浓度变化的原因可能是加入催化剂或缩小容器体积
C. 该反应在20 min时达到化学平衡状态
D. N2的平衡转化率与H2平衡转化率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表是元素周期表的一部分。
H | He | ||||||
Li | Be | B | C | N | O | F | Ne |
Na | Mg | Al | Si | P | S | Cl | Ar |
请回答下列问题。
(1)非金属性最强的元素名称为___________,它位于元素周期表中的位置___________。
(2)硅元素的原子结构示意图是____________,其最高价氧化物是____________(填“酸性”或“碱性”)氧化物。
(3)硼酸(H3BO3)的酸性_________(填“>” 或“<”)碳酸(H2CO3)的酸性,说明你判断的理由:__________________________。
(4)NH3的电子式为________________,它属于____________(填“离子”或“共价”)化合物。NH3的还原性_________(填“>” 或“<”)PH3的还原性。
(5)第三周期元素的最高价氧化物对应的水化物中,有一种物质既能与强酸反应又能与强碱反应,写出这种物质跟氢氧化钠溶液反应的化学方程式______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com