
【题目】元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表是元素周期表的一部分。
H | He | ||||||
Li | Be | B | C | N | O | F | Ne |
Na | Mg | Al | Si | P | S | Cl | Ar |
请回答下列问题。
(1)非金属性最强的元素名称为___________,它位于元素周期表中的位置___________。
(2)硅元素的原子结构示意图是____________,其最高价氧化物是____________(填“酸性”或“碱性”)氧化物。
(3)硼酸(H3BO3)的酸性_________(填“>” 或“<”)碳酸(H2CO3)的酸性,说明你判断的理由:__________________________。
(4)NH3的电子式为________________,它属于____________(填“离子”或“共价”)化合物。NH3的还原性_________(填“>” 或“<”)PH3的还原性。
(5)第三周期元素的最高价氧化物对应的水化物中,有一种物质既能与强酸反应又能与强碱反应,写出这种物质跟氢氧化钠溶液反应的化学方程式______________。
【答案】氟 第二周期 VIIA族 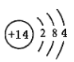 酸性 < B和C 位于同一周期,原子序数B<C,原子半径B>C,得电子能力B<C ,故非金属性B<C ,最高氧化物对应的水化物酸性H3BO3< H2CO3 (合理即可)
酸性 < B和C 位于同一周期,原子序数B<C,原子半径B>C,得电子能力B<C ,故非金属性B<C ,最高氧化物对应的水化物酸性H3BO3< H2CO3 (合理即可) ![]() 共价 < Al(OH)3 + NaOH = NaAlO2 + 2H2O
共价 < Al(OH)3 + NaOH = NaAlO2 + 2H2O
【解析】
根据元素周期表的结构及元素周期律分析解答;根据两性氢氧化物的性质书写对应化学方程式。
(1)同周期元素越往后非金属性越强,同主族元素越往上非金属性越强,所以非金属性最强的元素名称为氟;F原子序数为9,根据周期序数等于电子层数,主族序数等于最外层电子数的规律,F位于元素周期表中第二周期 VIIA族;
(2)硅元素的原子序数为14,位于周期表中第三周期、IVA族,其原子结构示意图是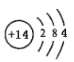 ;其最高价氧化物是二氧化硅,能和碱反应生成盐和水,属于酸性氧化物;
;其最高价氧化物是二氧化硅,能和碱反应生成盐和水,属于酸性氧化物;
(3) B和C 位于同一周期,非金属性B<C,非金属性越强,其最高价氧化物的水化物的酸性越强,所以硼酸(H3BO3)的酸性<碳酸(H2CO3)的酸性;
(4)NH3属于共价化合物,氮原子与氢原子通过3对共用电子对结合,其电子式为![]() ;化合物中只含有共价键,所以它属于共价化合物;元素单质氧化性越强,所形成的氢化物还原性就越弱,N的非金属性强于P,单质的氧化性N2强于P单质,所以NH3的还原性<PH3的还原性;
;化合物中只含有共价键,所以它属于共价化合物;元素单质氧化性越强,所形成的氢化物还原性就越弱,N的非金属性强于P,单质的氧化性N2强于P单质,所以NH3的还原性<PH3的还原性;
(5)第三周期元素形成的氢氧化物中呈两性的是氢氧化铝,与氢氧化钠溶液反应生成盐和水,化学方程式为:Al(OH)3 + NaOH = NaAlO2 + 2H2O。


科目:高中化学 来源: 题型:
【题目】在一密闭容器中充入一定量的N2和H2,发生反应N2(g)+3H2(g)![]() 2NH3(g),经测定反应开始后的2s内氢气的平均速率:ν(H2)=0.45mol/(L·s),则2s末NH3的浓度为
2NH3(g),经测定反应开始后的2s内氢气的平均速率:ν(H2)=0.45mol/(L·s),则2s末NH3的浓度为
A. 0.45mol/LB. 0.40mol/L
C. 0.55mol/LD. 0.60mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,可以证明反应 N2+3H2![]() 2NH3 已达平衡状态的是( )
2NH3 已达平衡状态的是( )
A. 一个N≡N键断裂的同时,有三个H-H键形成
B. 一个N≡N键断裂的同时,有三个H-H键断裂
C. 一个N≡N键断裂的同时,有两个N-H键断裂
D. 一个N≡N键断裂的同时,有六个N-H键形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题。
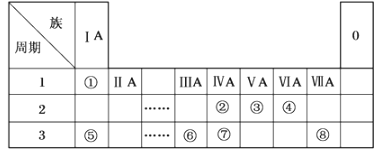
(1)①、②、③、④分别是_____、______、______、_____(用元素符号表示)
(2)描述⑦、⑧在周期表中的位置:第___周期,第_____族、第___周期,第____族
(3)①、③、④、⑥元素中的两种元素可形成含10个电子的分子,它们是_____、_____
(4)写出⑤的原子结构示意图_____________
(5)⑧的单质与氢氧化钠溶液反应的离子方程式_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子团SCN化合价为-1价,在很多方面跟卤素原子相似,因此称为“拟卤素”。拟卤素离子与卤离子还原性强弱顺序为Cl-<Br-<SCN-<I-,又知氧化性I2>S,下列反应不正确的是( )
A. (SCN)2+2Br-=Br2+2SCN-
B. (SCN)2+H2S=2H++2SCN-+S↓
C. 4H++2SCN-+MnO2![]() Mn2++(SCN)2↑+2H2O
Mn2++(SCN)2↑+2H2O
D. (SCN)2+2I-=2SCN-+I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①![]() 与
与![]() ;②O2与O3;③正丁烷(CH3CH2 CH2 CH3)与异丁烷
;②O2与O3;③正丁烷(CH3CH2 CH2 CH3)与异丁烷![]() ;④甲烷(CH4)与丙烷(C3H8)。
;④甲烷(CH4)与丙烷(C3H8)。
(1)互为同位素的是______(填序号,下同)。
(2)互为同系物的是______。
(3)互为同分异构体的是______。
(4)互为同素异形体的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为镁--次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是

A. 该燃料电池中镁为负极,发生还原反应
B. 电池的总反应式为Mg+ClO-+H2O===Mg(OH)2↓+Cl-
C. 放电过程中OH-移向负极
D. 酸性电解质的镁--过氧化氢燃料电池正极反应为:H2O2+2H++2e-===2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种以30%KOH溶液为电解质的氢氧燃料电池的公共汽车已在北京街头出现。下列有关该氢氧燃料电池的说法中,正确的是( )
A. H2在正极发生氧化反应
B. 供电时的总反应为:2H2+O2![]() 2H2O
2H2O
C. 氢氧燃料电池不仅能量转化率高,而且产物是水,属于环境友好电池
D. 氢氧燃料电池中H2和O2燃烧放出的热量转变为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检验某溶液中是否含有常见的四种无机离子,某化学小组的同学进行了如下所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得出的正确结论是( )

A.原溶液中一定含有SO42- B.原溶液中一定含有NH4+
C.原溶液中一定含有Cl- D.原溶液中一定含有Fe3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com