
【题目】AG表示溶液酸度:![]() 。常温下,用0.1mol/L的NaOH溶液滴定25 ml 0.1mol/L的CH3COOH滴定结果如图所示,下列分析正确的是()
。常温下,用0.1mol/L的NaOH溶液滴定25 ml 0.1mol/L的CH3COOH滴定结果如图所示,下列分析正确的是()
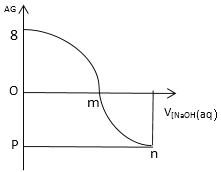
A.0.1mol/L的 CH3COOH溶液的pH=3
B.m点加入NaOH的体积为25mL
C.若pH=7,则溶液中水电离的c(OH-)=1.0×10-3.5 mol/L
D.随着NaOH溶液滴入,溶液中水的电离程度逐渐增大,m点最大
【答案】A
【解析】
A. 滴定起始时,V(NaOH)=0,溶液中仅存在醋酸,此时,![]() ,则
,则![]() ,又Kw=c(OH-) c(H+)=10-14,则溶液中c(H+)=10-3mol/L,因此0.1mol/L的 CH3COOH溶液的pH=3,A项正确;
,又Kw=c(OH-) c(H+)=10-14,则溶液中c(H+)=10-3mol/L,因此0.1mol/L的 CH3COOH溶液的pH=3,A项正确;
B. m点时,![]() ,则
,则![]() ,c(OH-)=(H+),溶液显中性,若加入NaOH的体积为25mL,则醋酸与NaOH恰好反应生成醋酸钠,溶液显碱性,此时应为醋酸钠和醋酸的混合溶液,加入NaOH的体积应小于25mL,B项错误;
,c(OH-)=(H+),溶液显中性,若加入NaOH的体积为25mL,则醋酸与NaOH恰好反应生成醋酸钠,溶液显碱性,此时应为醋酸钠和醋酸的混合溶液,加入NaOH的体积应小于25mL,B项错误;
C. 若pH=7,溶液显中性,此时应为醋酸钠和醋酸的混合溶液,二者对于水的电离的促进和抑制作用相等,则溶液中水电离的c(OH-)=1.0×10-7 mol/L,C项错误;
D. 随着NaOH溶液的滴入,发生反应CH3COOH+NaOH=CH3COONa+H2O,醋酸逐渐减少,水的电离程度逐渐增大,恰好反应生成醋酸钠时,水的电离程度最大,m点时溶液显中性,为醋酸钠和醋酸的混合溶液,电离程度不是最大,恰好反应后再继续加入氢氧化钠,水的电离程度逐渐减小,D项错误;
答案选A。


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCl(浓)![]() MnCl2 +Cl2↑+2H2O。若产生的氯气在标况下的体积为2.24L,试计算:
MnCl2 +Cl2↑+2H2O。若产生的氯气在标况下的体积为2.24L,试计算:
(1)参加反应的MnO2的质量____________
(2)参加反应的HCl的物质的量___________
(3)反应中被氧化的HCl的物质的量____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标准状况下:① 0.3mol氨气 ②6.02×1022个CO2分子 ③7.3gHCl ④ 0.2molCH4 。其中体积最大的是______;密度最大的是_____;质量最大的是_____。(填序号)
(2)相同质量的SO2与SO3,其物质的量之比为_________,氧元素的质量之比为_________,原子总数之比为____________。
(3)100mL 1 mol·L-1Al2(SO4)3溶液中含SO42-离子______个,含Al3+离子______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:稀Na3AsO3溶液、稀碘水和稀NaOH溶液混合,发生如下反应:AsO33-(aq)+I2(aq)+2OH-(aq)![]() AsO43-(aq)+2I-(aq)+H2O(l),反应一段时间后测得c(AsO43-)为amol·L-1。下列说法能判断反应达到平衡状态的是
AsO43-(aq)+2I-(aq)+H2O(l),反应一段时间后测得c(AsO43-)为amol·L-1。下列说法能判断反应达到平衡状态的是
A.c(I-)=2a mol·L—1
B.v (I-)=2v(AsO43-)
C.c(AsO43-)/c(I-)不再变化
D.溶液的pH不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解1.0 L c(Cl-)=3.0 mol/L的CuCl2、NaCl混合溶液,一段时间后,两极均收集到56.0 L的气体(标准状况下)。下列说法正确的是( )
A.阳极只收集到Cl2
B.电解前溶液呈弱酸性,电解结束后,溶液的酸性增强
C.整个过程中共转移电子5 mol
D.原混合溶液中c(Cu2+)=1.0 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】顺铂是一种用于治疗癌症的药物,它的结构如下图所示。关于1 mol顺铂的下列说法中,正确的是( )
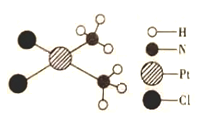
A.含氮元素的质量为14gB.含铂原子的数目约为6.02×1024
C.含氯元素的质量为35.5gD.含氢原子的物质的量6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度和压强下,在2 L的密闭容器中合成氨气:N2(g)+3H2(g)![]() 2NH3(g) 。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。下列说法错误的是:
2NH3(g) 。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。下列说法错误的是:
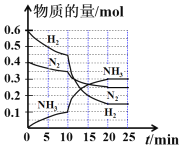
A. 0~10 min内,以NH3表示的平均反应速率为0.005 mol L-1 min-1
B. 10~20 min内,NH3浓度变化的原因可能是加入催化剂或缩小容器体积
C. 该反应在20 min时达到化学平衡状态
D. N2的平衡转化率与H2平衡转化率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作、现象和结论都正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向BaCl2溶液中通入CO2 | 产生白色沉淀 | 白色沉淀为BaCO3 |
B | 向 NaHCO3溶液中先加入CaCl2溶液,再加入NaOH溶液 | 产生白色沉淀 | 白色沉淀为CaCO3 |
C | 向某溶液加入NaOH溶液,用湿润的红色石蕊试纸检验产生的气体 | 湿润的红色石蕊试纸未变蓝 | 该溶液中一定不含有 |
D | 向某溶液中先加入HNO3溶液,再加入BaCl2溶液 | 产生白色沉淀 | 该溶液中一定含有 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙腈主要用于有机合成及生产医药,农药的中间体,对环境有危害。常温常压下,苯乙腈水解一般需加入酸碱催化剂。但研究人员发现,在近临界水(指温度在523~623K之间的压缩液态水)中,不加任何催化剂的情况下,苯乙腈就能发生水解反应生成苯乙酞胺:
C6H5CH2CN(l)+H2O(l)![]() C6H5CH2CONH2(l) △H
C6H5CH2CONH2(l) △H
(苯乙腈) (苯乙酰胺)
请回答下列问题:
(1)己知近临界水中,水的离子积常数为10-10,则此条件下,pH=7的NaAc溶液中由水电离的c(H+)=________ mol·L-1。该反应不加任何催化剂就能发生的主要原因是___________。
(2)研究反应的平衡常数(记作lgK)与温度(T)的关系,得到如图1所示的关系,判断该反应的△H__________0(填“>”“<”或“=”)。
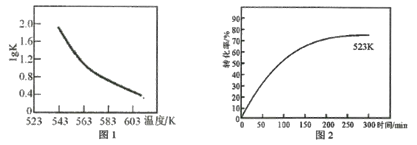
(3)图2表示其他条件不变时,温度和时间对苯乙腈转化率的影响曲线图(不完整)。若图中曲线对应的温度为523K,请你在原图中作出温度为583K的影响曲线。___________。
(4)下列哪种仪器可用于分析水解反应过程中苯乙腈浓度的变化_________(填编号)。
A.元素分析仪 B.核磁共振仪 C.原子吸收光谱仪 D.分光光度计
(5)科学家还在近临界水中分别添加CO2、NH3,研究后得到了如下的图示:
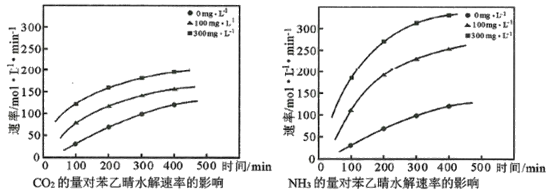
从中你可以得出什么结论(至少写出2点___________。
(6)水的用途很广,可利用太阳能光伏电池电解水制高纯氢,工作示意图如图。通过控制开关连接K1或K2,可交替得到H2和O2。
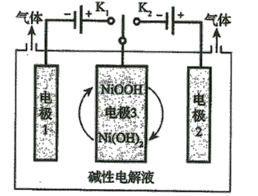
①制H2时,连接______________,可得H2。
②改变开关连接方式,产生O2的电极反应式__________________________。
③选用NiOOH、Ni(OH)2作为电极3材料的优点(请结合电极反应式进行阐述)___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com