
����Ŀ��ijϲ��ֲ�������ڵ��¶���(10 �桢6��)���Ž�����в��(2�桢12 h)����ϸ���ڳ��������绯ø (SOD����ø�ܼ���ֲ���˥��)���ԵĶ�̬�仯ͼ���¡�������ط����������
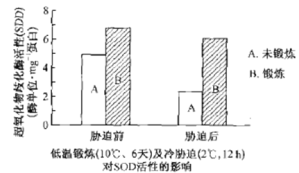
A.��ʵ��Ŀ��Ϊ̽�����¶����Ƿ������ֲ�������
B.δ��������в�Ⱥ�SOD���Խ�����������ռ�ṹ�����˸ı�
C.�����Ƿ����в�Ⱥ�SOD���ͻ�ѧ��Ӧ��ܵ�����������
D.���¶��������SOD������������в�Ⱥ�SOD������Խ��ȶ�
���𰸡�B
��������
����ͼʾ����ͼʾ���ݱ�ʾ�������֪��������в��ǰ����в�Ⱥ�������ֲ���к��еij��������绯øSOD���Ծ���δ������Ҫ�ߡ�
A����ͼ��֪��δ������ֲ����в��ǰ��ø�����½��̶����Ը��ھ���������ֲ�꣬����в��ǰ����в�Ⱥ������SOD���Զ�����������A��ȷ��
B�����»�ʹø�Ļ��Խ��ͣ�����ռ�ṹ���ı䣬B����
C�������Ƿ����в�Ⱥ�SOD���Ծ����ͣ�C��ȷ��
D�����¶��������SOD������������в���»����½�������SOD������Խ��ȶ���D��ȷ��
��ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����BaCl2��KCl�Ļ����ҺVL�������ֳ����ȷݡ�һ�ݵμ�ϡ���ᣬʹBa2����ȫ����������amolH2SO4����һ�ݵμ�AgNO3��Һ������bmolAgNO3ʹCl����ȫ������ԭ�����Һ�е�K�������ʵ���Ũ��Ϊ____mol��L-1��
��2��һ�������£�PbO2��Cr3����Ӧ��������Cr2O72-��Pb2��������1molCr3����Ӧ����PbO2�����ʵ���Ϊ____mol��
��3����һ�������£�ʵ���ҷֱ��Թ������⡢������ء�����ء���������Ϊԭ����ȡ���������Ƶ�ͬ��ͬѹ����ͬ���������ʱ���ĸ���Ӧ��ת�Ƶĵ�����֮��Ϊ_____��
��4������ˮ�е�NO3�������ཡ������Σ����Ϊ�˽�������ˮ��NO3����Ũ�ȣ�ij�о���Ա����ڼ�����������Al�ۻ�ԭNO3����������N2�������ķ�Ӧ�ɱ�ʾ���£�����ɷ���ʽ����ƽ��
___Al��___NO3-��___��___AlO2-+___N2����___H2O
��5��ij��ѧ��Ӧ�ķ�Ӧ��Ͳ��KMnO4+KI+H2SO4��MnSO4+I2+KIO3+K2SO4+H2O
�ٸ÷�Ӧ������������____��
�����÷�Ӧ����ʽ��I2��KIO3�ļ������ֱ���6��3��������1molI2ʱ��ת�Ƶ��ӵ����ʵ���Ϊ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ����
A.��״���£�0.1 mol![]() ����ˮ��ת�Ƶĵ�����ĿΪ0.1
����ˮ��ת�Ƶĵ�����ĿΪ0.1![]()
B.��״���£�2.24 L������2.3 g�����Ƴ�ַ�Ӧ��ת�Ƶĵ�����Ϊ0.4![]()
C.64 g ͭ����������ۻ�ϼ��ȳ�ַ�Ӧ��ת�Ƶ�����Ϊ![]()
D.18 g![]() ����10
����10![]() ������
������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1 molŨ��������ˮʱ�����������̣�һ�Dz���������ӷ�ɢ��ˮ��������������ЧӦΪ��![]() �����Dz������������ˮ�����γ�����ˮ�����ͷ���������ЧӦΪ��
�����Dz������������ˮ�����γ�����ˮ�����ͷ���������ЧӦΪ��![]() �����о���������������仯����
�����о���������������仯����![]()
![]() ��
��![]() ��
��![]() =��
=��![]()
��![]() ��
��![]()
![]() ��
��![]() =��
=��![]()
��![]()
![]() ��
��![]() =��
=��![]()
����˵����ȷ����
A.Ũ��������ˮֻ�л�ѧ�仯
B.��![]() ��
��![]() <0
<0
C.��![]() <0
<0
D.��![]() =��
=��![]() +��
+��![]() +��
+��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���轺�ڸ���ʱ������Ȼ���(![]() )������ɫ�ı仯������ʪ������������ɫ��ת���dz��ɫ��ʹ�÷dz����㡣ijѧϰС�����ʵ���Ʊ��Ȼ��ܣ������ĵ��������ϣ����������ƣ��������ϼ�Ϊ+2��+3��������ϡ����(��Ӧ���������������������ſ�˳������)�����ڴ����м�����300����������CoO(�۵�Ϊ1 935��)��400��900������
)������ɫ�ı仯������ʪ������������ɫ��ת���dz��ɫ��ʹ�÷dz����㡣ijѧϰС�����ʵ���Ʊ��Ȼ��ܣ������ĵ��������ϣ����������ƣ��������ϼ�Ϊ+2��+3��������ϡ����(��Ӧ���������������������ſ�˳������)�����ڴ����м�����300����������CoO(�۵�Ϊ1 935��)��400��900������![]() ��
��
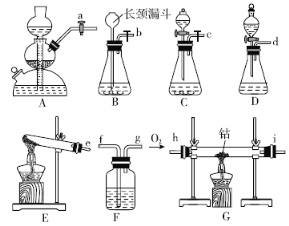
��ش��������⣺
(1)ʵ��١������Ʊ��������Լ���ϣ���� A��E ��ѡ����ǡ��װ�÷���������С�
ʵ�� ��� | �� | �� | �� | �� |
�Լ� | H2O2 ��Һ | H2O2 ��Һ | KMnO4 ���� | H2O2��Һ |
���� | MnO2��ĩ | FeCl3��Һ | ��Al2O3Ϊ���壬����MnO2�Ŀ�״�� | |
װ�� | ____ | ____ | ____ | ____ |
(2)��һС�鸺���Ʊ���ˮCoO����ѡ��װ��C��Ϊ�����ķ���װ�ã����Ʊ�CoO����װ�õĽӿ�����˳��Ϊ___________��װ��C������Ӧ�Ļ�ѧ����ʽΪ________��װ��F��װ�е��Լ�Ϊ_______��
(3)![]() ��
��![]() ���ƣ����Կ���������(CoO)����������(
���ƣ����Կ���������(CoO)����������(![]() )�γɵĻ����д��
)�γɵĻ����д��![]() �����ᷴӦ�Ļ�ѧ����ʽ��__________��
�����ᷴӦ�Ļ�ѧ����ʽ��__________��
(4)�ڶ�С��ͬѧ�������ķ�������һ���������ܷ���ϡ���ᷴӦ�����뼸��ϡ���ᣬ���õ���Һ�����������У���������Ũ����38��40����ȴ�ᾧ�����ȹ��ˣ��õ����塣������ͼ�ܽ�����¶ȱ仯���߽����ܵõ��Ȼ��ܾ����ԭ��____________��
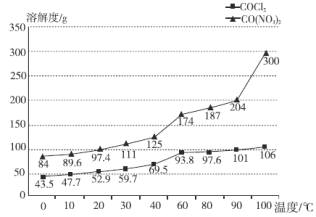
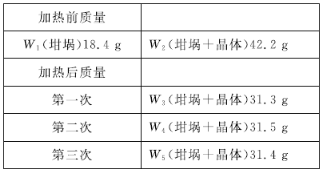
Ϊ��ȷ������Ļ�ѧʽ��С��ͬѧ�Ѿ���ϴ�ӡ���������õ�23.8 g���壬�������������������ٱ仯�����������ʾ����þ���Ļ�ѧʽΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ��Ӧ�����ӷ���ʽ��ȷ����(����)
A. �Ȼ�����Һ������İ�ˮ��Ӧ��Al3����4NH3��H2O===AlO![]() ��4NH
��4NH![]() ��2H2O
��2H2O
B. С�մ���Һ�м�������ij���ʯ��ˮ��Ca2����2OH����2HCO![]() ===CaCO3���� CO
===CaCO3���� CO![]() ��2H2O
��2H2O
C. ������Һ�еμ��������CO32-��H��===HCO![]()
D. ��FeCl3��Һ��ʴͭ��·�壺Fe3���� Cu === Fe2���� Cu2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β����NO�����ķ�ӦΪ��N2(g)+O2(g)![]() 2NO(g)��һ�������£������ʵ�����N2(g)��O2(g)�ں����ܱ������з�Ӧ����ͼ����a��ʾ�÷�Ӧ���¶�T��N2��Ũ����ʱ��ı仯������b��ʾ�÷�Ӧ��ijһ��ʼ��Ӧ�����ı�ʱN2��Ũ����ʱ��ı仯������������ȷ���ǣ�
2NO(g)��һ�������£������ʵ�����N2(g)��O2(g)�ں����ܱ������з�Ӧ����ͼ����a��ʾ�÷�Ӧ���¶�T��N2��Ũ����ʱ��ı仯������b��ʾ�÷�Ӧ��ijһ��ʼ��Ӧ�����ı�ʱN2��Ũ����ʱ��ı仯������������ȷ���ǣ�

A. �¶�T�£��÷�Ӧ��ƽ�ⳣ��K=![]()
B. �¶�T�£����ŷ�Ӧ�Ľ��У����������ܶȼ�С
C. ����b��Ӧ�������ı�����Ǽ����˴���
D. ������b��Ӧ�������ı����¶ȣ����жϸ÷�Ӧ����H��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Ʊ�1��2-��������ķ�Ӧԭ�����£�![]()
���ܴ��ڵ���Ҫ����Ӧ�У��Ҵ���Ũ����Ĵ�������140����ˮ�������ѣ�����������������Ҵ��Ʊ�1��2-���������װ����ͼ��ʾ���й������б����£�
�ش��������⣺
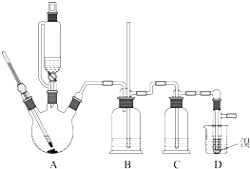
�Ҵ� | 1,2���������� | ���� | |
״̬ | ��ɫҺ�� | ��ɫҺ�� | ��ɫҺ�� |
�ܶ�/g.cm-3- | 0.79 | 2.2 | 0.71 |
�е�/�� | 78.5 | 132 | 34.6 |
�۵�/�� | -130 | 9 | -116 |
��1���ڴ��Ʊ�ʵ���У�Ҫ������Ѹ�ٵذѷ�Ӧ�¶���ߵ�170�����ң�������ҪĿ����______��������ȷѡ��ǰ����ĸ��
a ������Ӧ b �ӿ췴Ӧ�ٶ� c ��ֹ�Ҵ��ӷ� d ���ٸ�������������
��2��װ��B������_____________��
��3����װ��C��Ӧ����______����Ŀ�������շ�Ӧ�п������ɵ��������壻������ȷѡ��ǰ����ĸ��
a ˮ b Ũ���� c ����������Һ d ����̼��������Һ
��4���жϸ��Ʊ���Ӧ�Ѿ��������������___________����1��2-��������ֲ�Ʒ���ڷ�Һ©���м�ˮ�����ã�����Ӧ��______�㣨��������������������
��5����������������δ��Ӧ��Br2�������________ϴ�ӳ�ȥ�������������������������ѣ�����____�ķ�����ȥ��
��6����Ӧ������Ӧ����ˮ��ȴװ��D������ҪĿ����_______��
��7�����ֲ��ܹ�����ȴ�����ñ�ˮ������ԭ����_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����3.06 g����þ�Ļ�����ĩ����100 mL�����У�ǡ����ȫ��Ӧ�����õ���״����3.36 LH2 ���㣺��Ҫ�й��̣�
��1���úϽ����������ʵ���_____��
��2����Ӧ����Һ��Cl�������ʵ���Ũ�ȣ��ٶ���Ӧ�����Ϊ100 mL��____��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com