
【题目】钒的化合物常用于制催化剂和新型电池。回答下列问题:
(1) V2O5为黄褐色固体,无味、有毒,微溶于水,是许多反应的催化剂。25℃时,部分含钒微粒的存在形式、浓度及存在的pH范围之间的变化关系如图所示(其余可溶性微粒均未标出),图中“[V]”表示含钒微粒的浓度,虚线表示[V]或pH的范围尚未确定。
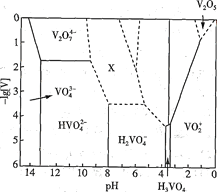
①V2O5溶于足量1.0 mol·L-1NaOH溶液中,发生反应的离子方程式为_____________________
②上述滴加H2SO4溶液的过程中,先后发生如下反应:

则“X所示区域的离子”不可能是____________(填标号)。
A.V3O93- B.V4 O103- C.V4 O124-
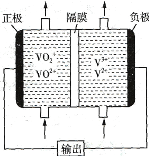
(2)如图所示为可充电的全钒液流电池构造示意图,该电池中的隔膜只允许H+通过。电池放电时,负极区溶液的pH将_________ (填“增大”“减小”或“不变”),电池充电时,阳极的电极反应式为_______________________________________。
【答案】V2O5+6OH-=2VO43-+3H2O B 增大 VO2+-e-+H2O=VO2++2H+
【解析】
(1)①V2O5溶于足量1.0 mol·L-1NaOH溶液中生成Na3VO4和水;
②上述滴加硫酸溶液的过程中,先后发生题干的反应,结合图象中微粒存在的pH进行分析判断;
(2)钒液流电池放电时负极的发生氧化反应,正极发生还原反应,充电时,阳极发生氧化反应;
(1)①由图可知碱性条件下,以VO43-形式存在,因此V2O5溶于足量1.0 mol·L-1NaOH溶液中,生成Na3VO4和水,反应的离子方程式为:V2O5+6OH-=2VO43-+3H2O;
②上述滴加硫酸溶液的过程中,先后发生题干的反应,H2VO4-缩合后,V的化合价不变,则“X所示区域的离子”不可能是V4 O103-,答案选B;
(2)钒液流电池放电时负极的发生氧化反应,电极反应为:V2+-e-=V3+,H+向正极移动,正极发生还原反应,负极区溶液pH增大,充电时,阳极发生氧化反应,电极反应为VO2+-e-+H2O=VO2++2H+。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体, 一定条件下发生如下反应: 3A(g) ![]() B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是( )
B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是( )

A. 若 t1=15 s,则用 A 的浓度变化表示 t0~t1阶段的平均反应速率为 0.004 mol·L-1·s-1
B. t1时该反应达到平衡, A 的转化率为 60%
C. 该容器的容积为2 L,B的起始的物质的量为 0.02 mol
D. t0~t1 阶段, 此过程中容器与外界的热交换总量为 a kJ,该反应的热化学方程式为 3A(g)![]() B(g)+2C(g) ΔH=-50a kJ·mol-1
B(g)+2C(g) ΔH=-50a kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向一个容积为2L的密闭容器内(预先加入催化剂)通入2molNH3,经过一段时间后,测得容器内的压强为起始时的1.2倍.则NH3的转化率为( )
A. 25%B. 80%C. 10%D. 20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:2H2(g) + O2(g) == 2H2O(g);△H= –483.6 kJ·mol-1, H2(g) + ![]() O2(g) == H2O(l) △H=–285.8 kJ·
O2(g) == H2O(l) △H=–285.8 kJ·![]() ,由此可知,在等温下蒸发45g液态水需吸收___________kJ的热量。
,由此可知,在等温下蒸发45g液态水需吸收___________kJ的热量。
(2)工业制氢气的一个重要反应是:CO(g)+H2O(g)==CO2(g)+H2(g),已知25℃时:
C(石墨)+O2(g)==CO2(g)△H1=-394kJ·mol-1
C(石墨)+![]() O2(g)==CO(g)△H2=-111kJ·mol-1
O2(g)==CO(g)△H2=-111kJ·mol-1
H2(g)+![]() O2(g)==H2O(g)△H3=-242kJ·mol-1
O2(g)==H2O(g)△H3=-242kJ·mol-1
试计算25℃时CO(g)+H2O(g)==CO2(g)+H2(g)的△H=______kJ·mol-1
(3) 在25℃、101KPa时,___时所放出的热量,叫做该反应的燃烧热。在25℃、101KPa时,1g乙醇完全燃烧生成CO2和液态水时放热29.713kJ,则能表示乙醇燃烧热的热化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10﹣4molL﹣1 | K1=4.4×10﹣6molL﹣1 K2=5.6×10﹣11molL﹣1 | 3.0×10﹣8 molL﹣1 |
请回答下列问题:
(1)同浓度的CH3COOH、H2CO3、HClO溶液的pH最大的是_____.
(2)常温下0.1molL﹣1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_____(填字母序号,下同).
A.c(H+)
B.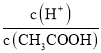
C.c(H+)c(OH﹣)
D.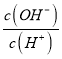
E.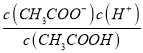
若该溶液升高温度,上述5种表达式的数据增大的是_________.
(3)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图:则HX的电离平衡常数_____(填“大于”、“等于”或“小于”)醋酸的平衡常数.稀释后,HX溶液中有水电离出来的c(H+)_____(填“大于”、“等于”或“小于”)醋酸的溶液中有水电离出来的c(H+),理由是___________.
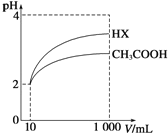
(4)已知100℃时,水的离子积为1×10﹣12,该温度下测得某溶液PH=7,该溶液显_____(填“酸”、“碱”或“中”)性.将此温度下PH=1的H2SO4溶液aL与PH=11的NaOH溶液bL混合,若所得混合液PH=2,则a:b=_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(气)+B(气)![]() 2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7 mol·L-1
其中正确的是:
A.①③B.①④C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白:
(1)选用的指示剂是______________________。
(2)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______________________。
(3)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______________。
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(4)若滴定开始和结束时,酸式滴定管中的液面如图所示,请将数据填入下面表格的横线处。
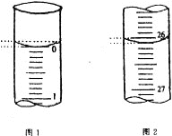
滴定次数 | 待测氢氧化钠溶液的体积/ mL | 0.1000 mol/L 盐酸的体积/ mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/ mL | ||
第一次 | 25.00 | 0.00 | ________ | _______ |
第二次 | 25.00 | 2.00 | 28.08 | 26.08 |
第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
(5)请根据上表中数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)= _________。
(6)滴定终点的判定依据是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质的叙述一定不正确的是
A. 向FeCl2溶液中滴加NH4SCN溶液,溶液显红色
B. KAl(SO4) 2·12H2O溶于水可形成 Al(OH)3胶体
C. NH4Cl与Ca(OH)2混合加热可生成NH3
D. Cu与FeCl3溶液反应可生成CuCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷精矿湿法制备磷酸的一种工艺流程如下:

已知:磷精矿主要成分为Ca5(PO4)3(OH),还含有Ca5(PO4)3F和有机碳等。
溶解度:Ca5(PO4)3(OH)<CaSO4·0.5H2O
(1)上述流程中能加快反应速率的措施有__________。
(2)磷精矿粉酸浸时发生反应:
2Ca5(PO4)3(OH)+3H2O+10H2SO4![]() 10CaSO4·0.5H2O+6H3PO4
10CaSO4·0.5H2O+6H3PO4
①该反应体现出酸性关系:H3PO4__________H2SO4(填“>”或“<”)。
②结合元素周期律解释①中结论:P和S电子层数相同,__________。
(3)酸浸时,磷精矿中Ca5(PO4)3F所含氟转化为HF,并进一步转化为SiF4除去。写出生成HF的化学方程式:__________。
(4)H2O2将粗磷酸中的有机碳氧化为CO2脱除,同时自身也会发生分解。相同投料比、相同反应时间,不同温度下的有机碳脱除率如图所示。80℃后脱除率变化的原因:____________________。

(5)脱硫时,CaCO3稍过量,充分反应后仍有SO42残留,原因是__________;加入BaCO3可进一步提高硫的脱除率,其离子方程式是____________________。
(6)取a g所得精制磷酸,加适量水稀释,以百里香酚酞作指示剂,用b mol·L1NaOH溶液滴定至终点时生成Na2HPO4,消耗NaOH溶液c mL,精制磷酸中H3PO4的质量分数是________。(已知:H3PO4摩尔质量为98 g·mol1)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com