
”¾ĢāÄæ”æ25”ꏱ£¬²æ·ÖĪļÖŹµÄµēĄėĘ½ŗā³£ŹżČē±ķĖłŹ¾£ŗ
»ÆѧŹ½ | CH3COOH | H2CO3 | HClO |
µēĄėĘ½ŗā³£Źż | 1.7”Į10©4molL©1 | K1=4.4”Į10©6molL©1 K2=5.6”Į10©11molL©1 | 3.0”Į10©8 molL©1 |
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©Ķ¬ÅØ¶ČµÄCH3COOH”¢H2CO3”¢HClOČÜŅŗµÄpH×ī“óµÄŹĒ_____£®
£Ø2£©³£ĪĀĻĀ0.1molL©1µÄCH3COOHČÜŅŗŌŚ¼ÓĖ®Ļ”ŹĶ¹ż³ĢÖŠ£¬ĻĀĮŠ±ķ“ļŹ½µÄŹż¾ŻŅ»¶Ø±äŠ”µÄŹĒ_____£ØĢī×ÖÄøŠņŗÅ£¬ĻĀĶ¬£©£®
A£®c£ØH+£©
B£®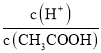
C£®c£ØH+£©c£ØOH©£©
D£®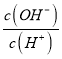
E£®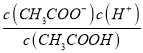
ČōøĆČÜŅŗÉżøßĪĀ¶Č£¬ÉĻŹö5ÖÖ±ķ“ļŹ½µÄŹż¾ŻŌö“óµÄŹĒ_________£®
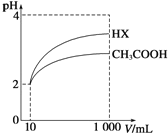
£Ø3£©Ģå»żĪŖ10mL pH=2µÄ“×ĖįČÜŅŗÓėŅ»ŌŖĖįHXČÜŅŗ·Ö±š¼ÓĖ®Ļ”ŹĶÖĮ1000mL£¬Ļ”ŹĶ¹ż³ĢpH±ä»ÆČēĶ¼£ŗŌņHXµÄµēĄėĘ½ŗā³£Źż_____£ØĢī”°“óÓŚ”±”¢”°µČÓŚ”±»ņ”°Š”ÓŚ”±£©“×ĖįµÄĘ½ŗā³£Źż£®Ļ”ŹĶŗó£¬HXČÜŅŗÖŠÓŠĖ®µēĄė³öĄ“µÄc£ØH+£©_____£ØĢī”°“óÓŚ”±”¢”°µČÓŚ”±»ņ”°Š”ÓŚ”±£©“×ĖįµÄČÜŅŗÖŠÓŠĖ®µēĄė³öĄ“µÄc£ØH+£©£¬ĄķÓÉŹĒ___________£®
£Ø4£©ŅŃÖŖ100”ꏱ£¬Ė®µÄĄė×Ó»żĪŖ1”Į10©12£¬øĆĪĀ¶ČĻĀ²āµĆijČÜŅŗPH=7£¬øĆČÜŅŗĻŌ_____£ØĢī”°Ėį”±”¢”°¼ī”±»ņ”°ÖŠ”±£©ŠŌ£®½«“ĖĪĀ¶ČĻĀPH=1µÄH2SO4ČÜŅŗaLÓėPH=11µÄNaOHČÜŅŗbL»ģŗĻ£¬ČōĖłµĆ»ģŗĻŅŗPH=2£¬Ōņa£ŗb=_____£®
”¾“š°ø”æHClO A ABCE “óÓŚ “óÓŚ HXĖįŠŌĒæÓŚCH3COOHµÄ£¬Ļ”ŹĶŗóHXČÜŅŗÖŠµÄc£ØH+£©Š”ÓŚCH3COOHČÜŅŗÖŠµÄc£ØH+£©£¬ĖłŅŌĘä¶ŌĖ®µēĄėµÄŅÖÖĘÄÜĮ¦Ņ²½ĻČõ ¼ī 11£ŗ9
”¾½āĪö”æ
½įŗĻ±ķÖŠŹż¾Ż£¬æÉÖŖĖįŠŌCH3COOH”¢H2CO3”¢HClO”¢HCO3-ŅĄ“Ī¼õČõ”£
£Ø1£©CH3COOH”¢H2CO3”¢HClOĖįŠŌŅĄ“Ī¼õČõ£¬¹ŹĶ¬ÅØ¶ČµÄCH3COOH”¢H2CO3”¢HClOČÜŅŗµÄpH×ī“óµÄŹĒHClO£»
£Ø2£©A”¢0.1mol/LµÄCH3COOHČÜŅŗ¼ÓĻ”ŹĶ¹ż³ĢÖŠ£¬ČÜŅŗÖŠĒāĄė×ÓÅØ¶Č¼õŠ”£¬ĖłŅŌAŃ”ĻīŹĒÕżČ·µÄ£»
B”¢0.1mol/LµÄCH3COOHČÜŅŗ¼ÓĻ”ŹĶ¹ż³ĢÖŠ£¬ø÷øöĪ¢Į£ÅØ¶Č¼õŠ”£¬Ķ¬Ź±“×ĖįµÄµēĄėĻņÓŅŅĘ¶Æ£¬ c£ØH+£©¼õŠ”µÄ³Ģ¶ČŠ”ÓŚCH3COOHµÄ¼õŠ”³Ģ¶Č£¬ĖłŅŌ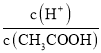 Ōö“󣬹ŹB“ķĪó£»
Ōö“󣬹ŹB“ķĪó£»
C”¢![]() Ö»ŹÜĪĀ¶ČµÄÓ°Ļģ£¬ĪĀ¶Č²»±äŌņĘäÖµŹĒŅ»øö³£Źż£¬¹ŹC“ķĪó£»
Ö»ŹÜĪĀ¶ČµÄÓ°Ļģ£¬ĪĀ¶Č²»±äŌņĘäÖµŹĒŅ»øö³£Źż£¬¹ŹC“ķĪó£»
D”¢“×ĖįĻ”ŹĶ£¬ĖįŠŌ¼õČõ£¬ c£ØH+£©¼õŠ”£¬Ė®µÄĄė×Ó»ż²»±ä£¬Ōņc£ØOH-£©Ōö“ó£¬ĖłŅŌ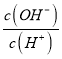 Ōö“󣬹ŹD“ķĪó£»
Ōö“󣬹ŹD“ķĪó£»
E”¢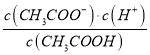 ĪŖ“×ĖįµÄµēĄėĘ½ŗā³£Źż£¬ŅņĪŖĪĀ¶Č²»±ä£¬ŌņĖ®µÄµēĄėĘ½ŗā³£Źż²»±ä£¬¹ŹE“ķĪó£»
ĪŖ“×ĖįµÄµēĄėĘ½ŗā³£Źż£¬ŅņĪŖĪĀ¶Č²»±ä£¬ŌņĖ®µÄµēĄėĘ½ŗā³£Źż²»±ä£¬¹ŹE“ķĪó£»
Ņņ“Ė£¬±¾ĢāÕżČ·“š°øŹĒ£ŗA£»
ČōøĆČÜŅŗÉżøßĪĀ¶Č£¬“×Ėį”¢Ė®µÄµēĄė³Ģ¶Č¶ŌŌö“ó£¬ŌņČÜŅŗÖŠĒāĄė×Ó”¢ĒāŃõøłĄė×ÓÅØ¶Č¶¼Ōö“ó£¬
A.ÉżøßĪĀ¶ČŗóČÜŅŗÖŠĒāĄė×ÓÅضČc£ØH+£©Ōö“ó£¬ĖłŅŌAŃ”ĻīŹĒÕżČ·µÄ£»
B.ÉżøßĪĀ¶ČŗóĒāĄė×Ó”¢ĒāŃõøłĄė×ÓÅØ¶Č¶¼Ōö“ó£¬ 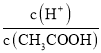 £¬“×ĖįµÄÅØ¶Č¼õŠ”£¬ŌņøƱČÖµŌö“ó£¬ĖłŅŌBŃ”ĻīŹĒÕżČ·µÄ£»
£¬“×ĖįµÄÅØ¶Č¼õŠ”£¬ŌņøƱČÖµŌö“ó£¬ĖłŅŌBŃ”ĻīŹĒÕżČ·µÄ£»
C. c£ØH+£©c£ØOH©£©ĪŖĖ®µÄĄė×Ó»ż£¬ÉżøßĪĀ¶ČŗóĖ®µÄµēĄė³Ģ¶ČŌö“ó£¬ŌņĖ®µÄĄė×Ó»żŌö“ó£¬ĖłŅŌCŃ”ĻīŹĒÕżČ·µÄ£»
D£®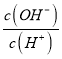 ÉżøßĪĀ¶ČŗóĒāŃõøłĄė×Ó”¢ĒāĄė×ÓÅØ¶Č¶¼Ōö“󣬵«ĒāĄė×ÓÅضČŌö“óµÄ·ł¶Č“óÓŚĒāŃõøłĄė×Ó£¬ĖłŅŌøƱČÖµ¼õŠ”£¬¹ŹD“ķĪó£»
ÉżøßĪĀ¶ČŗóĒāŃõøłĄė×Ó”¢ĒāĄė×ÓÅØ¶Č¶¼Ōö“󣬵«ĒāĄė×ÓÅضČŌö“óµÄ·ł¶Č“óÓŚĒāŃõøłĄė×Ó£¬ĖłŅŌøƱČÖµ¼õŠ”£¬¹ŹD“ķĪó£»
E£®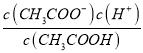 ĪŖ“×ĖįµÄµēĄėĘ½ŗā³£Źż£¬ÉżøßĪĀ¶Čŗó²śÉśµÄµēĄėĘ½ŗā³£ŹżŌö“󣬹ŹEÕżČ·£»
ĪŖ“×ĖįµÄµēĄėĘ½ŗā³£Źż£¬ÉżøßĪĀ¶Čŗó²śÉśµÄµēĄėĘ½ŗā³£ŹżŌö“󣬹ŹEÕżČ·£»
Ņņ“Ė£¬±¾ĢāÕżČ·“š°øŹĒ£ŗABCE.
(3)øł¾ŻĶ¼Ļó·ÖĪöÖŖµĄ£¬ĘšŹ¼ŹĒĮ½ÖÖČÜŅŗÖŠc£ØH+£©ĻąĶ¬£¬c(½ĻČõĖį)>c(½ĻĒæĖį)£¬Ļ”ŹĶ¹ż³ĢÖŠ½ĻČõĖįµÄµēĄė³Ģ¶ČŌö“󣬹ŹŌŚÕūøöĻ”ŹĶ¹ż³ĢÖŠ½ĻČõĖįµÄc£ØH+£©Ņ»Ö±“óÓŚ½ĻĒæĖįµÄc£ØH+£©£¬Ļ”ŹĶĻąĶ¬±¶Źż£¬HXµÄpH±ä»Æ±ČCH3COOHµÄ“󣬹ŹHXĖįŠŌĒ棬µēĄėĘ½ŗā³£Źż“ó£»HXĖįŠŌĒæÓŚCH3COOHµÄ£¬Ļ”ŹĶŗóHXČÜŅŗÖŠc£ØH+£©Š”ÓŚCH3COOHČÜŅŗÖŠµÄc£ØH+£©£¬ĖłŅŌ¶ŌĖ®µÄŅÖÖĘÄÜĮ¦¼õČõ£»
(4)100”ꏱ£¬Ė®µÄĄė×Ó»żĪŖ![]() £¬
£¬![]() £¬pH=6£¬ĪŖÖŠŠŌČÜŅŗ£¬øĆĪĀ¶ČĻĀ²āµĆijČÜŅŗpH=7£¬øĆČÜŅŗĻŌ¼īŠŌ£¬½«“ĖĪĀ¶ČĻĀpH=1µÄ
£¬pH=6£¬ĪŖÖŠŠŌČÜŅŗ£¬øĆĪĀ¶ČĻĀ²āµĆijČÜŅŗpH=7£¬øĆČÜŅŗĻŌ¼īŠŌ£¬½«“ĖĪĀ¶ČĻĀpH=1µÄ![]() ČÜŅŗaLÓėpH=11µÄNaOHČÜŅŗbL»ģŗĻ£¬ČōĖłµĆ»ģŗĻŅŗpH=2ĖµĆ÷ČÜŅŗĻŌĖįŠŌ£¬
ČÜŅŗaLÓėpH=11µÄNaOHČÜŅŗbL»ģŗĻ£¬ČōĖłµĆ»ģŗĻŅŗpH=2ĖµĆ÷ČÜŅŗĻŌĖįŠŌ£¬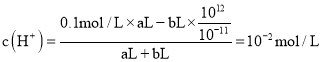 £¬ a£ŗb=11£ŗ9”£
£¬ a£ŗb=11£ŗ9”£


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓŠ»śĪļÖÖĄą·±¶ą£¬ĒėŅŌÄć¶ŌÓŠ»śĪļµÄČĻŹ¶ĢīæÕ£ŗ
(1)ĻĀĮŠ¼ø×éĪļÖŹÖŠ£¬»„ĪŖĶ¬Ī»ĖŲµÄŹĒ__£¬»„ĪŖĶ¬ĖŲŅģŠĪĢåµÄŹĒ__£¬»„ĪŖĶ¬ĻµĪļµÄŹĒ___£¬»„ĪŖĶ¬·ÖŅģ¹¹ĢåµÄŹĒ___”£
¢ŁO2ŗĶO3£»¢Ś35ClŗĶ37Cl£»¢ŪCH3CH3ŗĶCH3CH2CH3£»¢Ü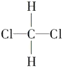 ŗĶ
ŗĶ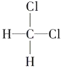 £»¢ŻCH3(CH2)2CH3ŗĶ(CH3)2CHCH3£»¢Ž
£»¢ŻCH3(CH2)2CH3ŗĶ(CH3)2CHCH3£»¢Ž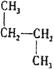 ŗĶ
ŗĶ![]() £»¢ß
£»¢ß![]() ŗĶCH3(CH2)3CH3£»
ŗĶCH3(CH2)3CH3£»
(2)ĻĀĮŠø÷ĶéĢžµÄ·ŠµćÓÉøßµ½µĶµÄĖ³ŠņĪŖ___(ÓĆ×ÖÄø±ķŹ¾)
A.ÕżĪģĶé B.ŅģĪģĶé C.CH3(CH2)2CH3 D.ŠĀĪģĶé E.C3H8
(3)¾ŪŅŅĻ©æÉÓĆÓŚÖĘŌģŹ³Ę·°ü×°“ü£¬ÓÉŅŅĻ©Öʱø¾ŪŅŅĻ©µÄ»Æѧ·½³ĢŹ½ĪŖ___”£
(4)±ūĻ©ÖŠ“¦ÓŚĶ¬Ņ»Ę½ĆęµÄŌ×Ó×ī¶ąÓŠ___øö£¬±ūĻ©Ź¹äåĖ®ĶŹÉ«£¬Ęä»Æѧ·½³ĢŹ½ĪŖ___£¬øĆ·“Ó¦µÄĄąŠĶŹĒ___”£
(5)1molijĶéĢžĶźČ«Č¼ÉÕŹ±ĻūŗÄŃõĘųµÄĪļÖŹµÄĮæĪŖ11mol£¬Ęä»ÆѧŹ½ĪŖ___£¬Ęä½į¹¹ÖŠŗ¬ÓŠ3øö-CH3µÄ½į¹¹¼ņŹ½·Ö±šĪŖ£ŗ___”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijĪĀ¶ČĻĀŌŚĆܱÕČŻĘ÷ÖŠ·¢ÉśČēĻĀæÉÄę·“Ó¦£ŗ2M(g)£«N(g)![]() 2E(g)£¬ČōæŖŹ¼Ź±Ö»³äČė2mol E(g)£¬“ļĘ½ŗāŹ±£¬EµÄ×Ŗ»ÆĀŹĪŖ40%£»ČōæŖŹ¼Ź±³äČė2mol MŗĶ1mol NµÄ»ģŗĻĘųĢ壬“ļĘ½ŗāŹ±»ģŗĻĘųĢåµÄŃ¹Ēæ±ČĘšŹ¼Ź±¼õÉŁĮĖ(””””)
2E(g)£¬ČōæŖŹ¼Ź±Ö»³äČė2mol E(g)£¬“ļĘ½ŗāŹ±£¬EµÄ×Ŗ»ÆĀŹĪŖ40%£»ČōæŖŹ¼Ź±³äČė2mol MŗĶ1mol NµÄ»ģŗĻĘųĢ壬“ļĘ½ŗāŹ±»ģŗĻĘųĢåµÄŃ¹Ēæ±ČĘšŹ¼Ź±¼õÉŁĮĖ(””””)
A.20%B.40%C.60%D.80%
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĢśĢ¼Ī¢µē½ā¼¼ŹõŹĒĄūÓĆŌµē³ŲŌĄķ“¦ĄķĖįŠŌĪŪĖ®µÄŅ»ÖÖ¹¤ŅÕ£¬×°ÖĆČēĶ¼”£ČōÉĻ¶ĖæŖæŚ¹Ų±Õ£¬æɵƵ½Ē滹ŌŠŌµÄH”¤ (ĒāŌ×Ó)£»ČōÉĻ¶ĖæŖæŚ“ņæŖ£¬²¢¹ÄČėæÕĘų£¬æɵƵ½ĒæŃõ»ÆŠŌµÄ”¤OH (ōĒ»ł×ŌÓÉ»ł)”£ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ( )”£
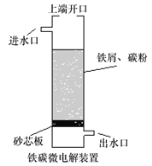
A.ĪŽĀŪŹĒ·ń¹ÄČėæÕĘų£¬øŗ¼«µÄµē¼«·“Ó¦Ź½¾łĪŖFe-2e-=Fe2+
B.²»¹ÄČėæÕĘųŹ±£¬Õż¼«µÄµē¼«·“Ó¦Ź½ĪŖH++e-= H”¤
C.¹ÄČėæÕĘųŹ±£¬ĆæÉś³É1mol”¤OHÓŠ2molµē×Ó·¢Éś×ŖŅĘ
D.“¦Ąķŗ¬ÓŠ²ŻĖį(H2C2O4)µÄĪŪĖ®Ź±£¬ÉĻ¶ĖæŖæŚ²»ŠčŅŖÓ¦“ņæŖ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”湤ŅµÉĻ»ŲŹÕĄūÓĆijŗĻ½š·ĻĮĻ(Ö÷ŅŖŗ¬Fe”¢Cu”¢Co”¢LiµČ£¬ŅŃÖŖCo”¢Fe¶¼ŹĒÖŠµČ»īĘĆ½šŹō)µÄ¹¤ŅÕĮ÷³ĢČēĻĀ£ŗ
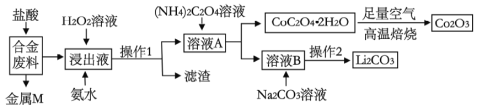
(1)ŗĻ½š·ĻĮĻÖŠ¼ÓČėŃĪĖį½žČ”£¬“Ė“¦ŃĪĖį²»ÄÜ»»ĪŖĻõĖį£¬ŌŅņŹĒ_______________”£
(2)²Ł×÷1ÓƵ½µÄ²£Į§ŅĒĘ÷ÓŠ__________________________”£
(3)½ž³öŅŗÖŠ¼ÓČėH2O2ČÜŅŗŗĶ°±Ė®£¬Ó¦ĻČ¼ÓČė_____________£¬¼ÓČė°±Ė®·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ____________________”£
(4)ŌŚæÕĘųÖŠ±ŗÉÕCoC2O4”¤2H2OµÄ»Æѧ·½³ĢŹ½ŹĒ____________________”£
(5)ŅŃÖŖLi2CO3Ī¢ČÜÓŚĖ®£¬Ę䱄ŗĶČÜŅŗµÄÅضČÓėĪĀ¶Č¹ŲĻµ¼ūĻĀ±ķ
ĪĀ¶Č/”ę | 10 | 30 | 60 | 90 |
ÅضČ/molL-1 | 0.21 | 0.17 | 0.14 | 0.10 |
Ōņ²Ł×÷2µÄ¾ßĢåĮ÷³ĢŹĒ_______________”¢_____________”¢Ļ“µÓ”¢øÉŌļ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ·°µÄ»ÆŗĻĪļ³£ÓĆÓŚÖĘ“ß»Æ¼ĮŗĶŠĀŠĶµē³Ų”£»Ų“šĻĀĮŠĪŹĢā£ŗ
(1) V2O5ĪŖ»ĘŗÖÉ«¹ĢĢ壬ĪŽĪ¶”¢ÓŠ¶¾£¬Ī¢ČÜÓŚĖ®£¬ŹĒŠķ¶ą·“Ó¦µÄ“߻ƼĮ”£25”ꏱ£¬²æ·Öŗ¬·°Ī¢Į£µÄ“ęŌŚŠĪŹ½”¢ÅØ¶Č¼°“ęŌŚµÄpH·¶Ī§Ö®¼äµÄ±ä»Æ¹ŲĻµČēĶ¼ĖłŹ¾(ĘäÓąæÉČÜŠŌĪ¢Į£¾łĪ“±ź³ö)£¬Ķ¼ÖŠ”°[V]”±±ķŹ¾ŗ¬·°Ī¢Į£µÄÅØ¶Č£¬ŠéĻß±ķŹ¾[V]»ņpHµÄ·¶Ī§ÉŠĪ“Č·¶Ø”£
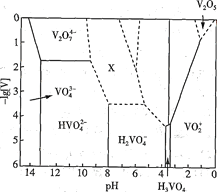
¢ŁV2O5ČÜÓŚ×ćĮæ1.0 mol”¤L-1NaOHČÜŅŗÖŠ£¬·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ_____________________
¢ŚÉĻŹöµĪ¼ÓH2SO4ČÜŅŗµÄ¹ż³ĢÖŠ£¬ĻČŗó·¢ÉśČēĻĀ·“Ó¦£ŗ

Ōņ”°XĖłŹ¾ĒųÓņµÄĄė×Ó”±²»æÉÄÜŹĒ____________(Ģī±źŗÅ)”£
A.V3O93- B.V4 O103- C.V4 O124-
(2)ČēĶ¼ĖłŹ¾ĪŖæɳäµēµÄČ«·°ŅŗĮ÷µē³Ų¹¹ŌģŹ¾ŅāĶ¼£¬øƵē³ŲÖŠµÄøōĤֻŌŹŠķH+Ķعż”£µē³Ų·ÅµēŹ±£¬øŗ¼«ĒųČÜŅŗµÄpH½«_________ (Ģī”°Ōö“ó”±”°¼õŠ””±»ņ”°²»±ä”±)£¬µē³Ų³äµēŹ±£¬Ńō¼«µÄµē¼«·“Ó¦Ź½ĪŖ_______________________________________”£
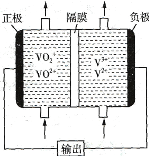
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŹµŃéŹŅŅŌÉßĪĘŹÆĖį½ž³öŅŗ£ØÖ÷ŅŖŗ¬Fe3+£¬»¹ÓŠŅ»¶ØĮæµÄAl3+”¢Mn2+”¢Ca2+”¢Mg2+µČ£©ĪŖŌĮĻÖʱøøß“æŃõ»ÆĢś£¬Į÷³ĢČēĻĀ£ŗ

ŅŃÖŖĮ÷³ĢÖŠĻą¹Ų½šŹōĄė×ÓÉś³ÉĒāŃõ»ÆĪļ³ĮµķµÄpHČēĻĀ±ķ£ŗ
ĒāŃõ»ÆĪļ | Fe3+ | Fe2+ | Al3+ |
æŖŹ¼³ĮµķµÄpH | 1.1 | 5.8 | 3.0 |
³ĮµķĶźČ«µÄpH | 3.2 | 8.8 | 5.0 |
£Ø1£©”°»¹Ō”±Ź±£¬Ó¦Ń”Ōń_____________£ØĢī×ÖÄø£©”£
A£®Zn·Ū B£®NaClOČÜŅŗ C£®Fe·Ū
£Ø2£©”°ĀĖŌü”±µÄÖ÷ŅŖ³É·Ö³żŗ¬ÓŠÉŁĮæMnF2Ķā£¬»¹ŗ¬ÓŠ_____________£ØĢī»ÆѧŹ½£©”£
£Ø3£©”°³ĮĆĢ”±Ź±£¬ŅŃÖŖ£ŗKsp(MnS)£½4.65”Į10ØC14”£ĪŖČ·±£³ĮĆĢĶźČ«[¼“ČÜŅŗÖŠc(Mn2£«)£¼1.0”Į10ØC6 mol”¤L1]£¬Ó¦±£³ÖČÜŅŗÖŠc(S2-)£¾_____________mol”¤L£1”£
£Ø4£©”°³żĀĮ”±Ź±£¬æŲÖĘČÜŅŗpHµÄ·¶Ī§ĪŖ_____________”£
£Ø5£©”°Ńõ»Æ”±Ź±£¬³£ÓĆĖįŠŌK2Cr2O7ČÜŅŗ¼ģ²āŹĒ·ń²ŠĮōĪ“±»Ńõ»ÆµÄ½šŹōĄė×Ó£¬øĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ_____________”£
£Ø6£©”°³ĮĢś”±Ź±£¬·“Ó¦ĪĀ¶ČĪŖ85”ęĢõ¼žĻĀ£¬·“Ó¦Ź±¼äŗĶ·“Ó¦ÖÕµćpH¶ŌĢśµÄ³ĮµķĀŹµÄÓ°Ļģ·Ö±šČēĻĀĶ¼ĖłŹ¾£¬Ōņ×ī¼ŃµÄ¹¤ŅÕĢõ¼žŹĒ_____________”£

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijĪŽÉ«ČÜŅŗÖŠæÉÄÜŗ¬ÓŠ![]() ”¢
Ӣ![]() Ӣ
Ӣ![]() Ӣ
Ӣ![]() Ӣ
Ӣ![]() Ӣ
Ӣ![]() Ӣ
Ӣ![]() Ӣ
”¢![]() Õā¼øÖÖĄė×ÓÖŠµÄČōøÉÖÖ£¬ŅĄ“Ī½ųŠŠĻĀĮŠŹµŃ飬¹Ū²ģµ½µÄĻÖĻó¼ĒĀ¼ČēĻĀ£ŗ¢Ł
Õā¼øÖÖĄė×ÓÖŠµÄČōøÉÖÖ£¬ŅĄ“Ī½ųŠŠĻĀĮŠŹµŃ飬¹Ū²ģµ½µÄĻÖĻó¼ĒĀ¼ČēĻĀ£ŗ¢Ł![]() ŹŌÖ½¼ģŃ飬ČÜŅŗµÄ
ŹŌÖ½¼ģŃ飬ČÜŅŗµÄ![]() ¢ŚČ”ÉŁĮæŌČÜŅŗ£¬ĻņČÜŅŗÖŠ¼ÓČė¹żĮæµÄ
¢ŚČ”ÉŁĮæŌČÜŅŗ£¬ĻņČÜŅŗÖŠ¼ÓČė¹żĮæµÄ![]() ŗĶŃĪĖįµÄ»ģŗĻČÜŅŗ£¬ĪŽ°×É«³ĮµķÉś³É¢ŪĮķȔɣĮæŌČÜŅŗ£¬ĻņČÜŅŗÖŠµĪ¼Ó×ćĮæĀČĖ®”¢ĪŽĘųĢå²śÉś£¬ŌŁ¼ÓČė
ŗĶŃĪĖįµÄ»ģŗĻČÜŅŗ£¬ĪŽ°×É«³ĮµķÉś³É¢ŪĮķȔɣĮæŌČÜŅŗ£¬ĻņČÜŅŗÖŠµĪ¼Ó×ćĮæĀČĖ®”¢ĪŽĘųĢå²śÉś£¬ŌŁ¼ÓČė![]() Õńµ“£¬¾²ÖĆŗó
Õńµ“£¬¾²ÖĆŗó![]() ²ć³Ź³ČÉ«£¬ÓĆ·ÖŅŗĀ©¶··ÖŅŗ¢ÜĻņ·ÖŅŗŗóµÄĖ®ČÜŅŗÖŠ¼ÓČė
²ć³Ź³ČÉ«£¬ÓĆ·ÖŅŗĀ©¶··ÖŅŗ¢ÜĻņ·ÖŅŗŗóµÄĖ®ČÜŅŗÖŠ¼ÓČė![]() ŗĶ
ŗĶ![]() ČÜŅŗ£¬ÓŠ°×É«³Įµķ²śÉś¢ŻŌŚĀĖŅŗÖŠ¼ÓČė
ČÜŅŗ£¬ÓŠ°×É«³Įµķ²śÉś¢ŻŌŚĀĖŅŗÖŠ¼ÓČė![]() ŗĶ
ŗĶ![]() µÄ»ģŗĻČÜŅŗÓŠ°×É«³Įµķ²śÉś”£Ōņ¹ŲÓŚŌČÜŅŗµÄÅŠ¶ĻÖŠÕżČ·µÄŹĒ
µÄ»ģŗĻČÜŅŗÓŠ°×É«³Įµķ²śÉś”£Ōņ¹ŲÓŚŌČÜŅŗµÄÅŠ¶ĻÖŠÕżČ·µÄŹĒ
A.æĻ¶Ø²»“ęŌŚµÄĄė×ÓŹĒ![]() ”¢
Ӣ![]() Ӣ
Ӣ![]() Ӣ
Ӣ![]()
B.æĻ¶Ø“ęŌŚµÄĄė×ÓŹĒ![]() ”¢
Ӣ![]() Ӣ
Ӣ![]()
C.ĪŽ·ØČ·¶ØŌČÜŅŗÖŠŹĒ·ń“ęŌŚ![]() ŗĶ
ŗĶ![]()
D.Čō²½Öč¢ÜøÄÓĆ![]() ŗĶŃĪĖįµÄ»ģŗĻČÜŅŗ£¬Ōņ¶ŌČÜŅŗÖŠĄė×ÓµÄÅŠ¶ĻŅ²ĪŽÓ°Ļģ
ŗĶŃĪĖįµÄ»ģŗĻČÜŅŗ£¬Ōņ¶ŌČÜŅŗÖŠĄė×ÓµÄÅŠ¶ĻŅ²ĪŽÓ°Ļģ
²éæ““š°øŗĶ½āĪö>>
¹ś¼ŹŃ§Š£ÓÅŃ” - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com