
【题目】下列是从海藻灰和智利硝石矿层中提取碘的主要反应:①2NaI+MnO2+3H2SO4===2NaHSO4+MnSO4+2H2O+I2 ;②2NaIO3+5NaHSO3===2Na2SO4+3NaHSO4+H2O+I2下列说法正确的是( )
A. 氧化性:MnO2>SO![]() >IO
>IO![]() >I2
>I2
B. I2在反应①中是还原产物,在反应②中是氧化产物
C. 反应①②中生成等量的I2时转移电子数之比为1∶5
D. NaHSO3溶液呈酸性,NaHSO3溶液中c(HSO![]() )>c(H2SO3)>c(SO
)>c(H2SO3)>c(SO![]() )
)
【答案】C
【解析】
①中I被氧化,Mn被还原,MnO2为氧化剂,NaI为还原剂,②中I被还原,S被氧化,NaIO3为氧化剂,NaHSO3为还原剂,结合氧化剂氧化性大于氧化产物的氧化性分析。
A、氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,反应①中MnO2>I2;反应②中IO![]() >SO
>SO![]() ,故A错误;
,故A错误;
B、在反应①中,I元素化合价升高,被氧化,I2为氧化产物,在反应②中,I元素化合价降低,被还原,I2为还原产物,故B错误;
C、反应①、②中生成等量的I2时,假设都为1 mol,则反应①转移2 mol电子,反应②转移10 mol电子,则转移电子数之比为1∶5,故C正确;
D、NaHSO3溶液呈酸性,则HSO![]() 的电离程度大于水解程度,所以c(SO
的电离程度大于水解程度,所以c(SO![]() )>c(H2SO3),则c(HSO
)>c(H2SO3),则c(HSO![]() )>c(SO
)>c(SO![]() ) >c(H2SO3),故D错误。
) >c(H2SO3),故D错误。
故选C。


科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的是:
A.2SO2+O2![]() 2SO3 ΔH=-196.6 kJ·mol-1
2SO3 ΔH=-196.6 kJ·mol-1
B.H2(g)+ ![]() O2(g)=H2O(l) ΔH=-285.5 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.5 kJ·mol-1
C.2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ
D.C(s)+O2(g)=CO2(g) ΔH=+393.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A. 水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
B. CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+
CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+
C. H原子的电子云图如图所示,H原子核外的大多数电子在原子核附近运动
H原子的电子云图如图所示,H原子核外的大多数电子在原子核附近运动
D. 金属Ag的原子堆积模型如图所示,该金属晶体为最密堆积,每个Ag原子的配位数均为12
金属Ag的原子堆积模型如图所示,该金属晶体为最密堆积,每个Ag原子的配位数均为12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 由图甲表示的反应速率随温度变化的关系可知该反应的ΔH>0
B. 图乙表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是醋酸
C. 图丙表示该反应为放热反应,且催化剂能改变反应的焓变
D. 图丁表示向Na2CO3溶液中逐滴滴加稀盐酸,生成CO2与所加盐酸物质的量的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为VL的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g)![]() 2HBr(g);△H<0.当温度分别为T1、T2达平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示.下列说法不正确的是
2HBr(g);△H<0.当温度分别为T1、T2达平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示.下列说法不正确的是

A.a、b两点的反应速率:b>a
B.T1>T2
C.T1时,随着Br2(g)加入,平衡时HBr的体积分数不断增加
D.为了提高Br2(g)的转化率,可采取将HBr液化并及时移走的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】节能减排措施是我国“十一五”期间提出的政策措施。
(1)煤的燃烧,会产生大量有害气体。将煤转化为水煤气,可有效降低排放。
C(s)+O2(g)=CO2(g) △H=-393.5 kJ·mol-1
H2(g)+ ![]() O2(g)=H2O(g) △H=-242.0kJ·mol-1
O2(g)=H2O(g) △H=-242.0kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) △H=-283.0kJ·mol-1
O2(g)=CO2(g) △H=-283.0kJ·mol-1
根据以上数据,写出C(s)与水蒸气反应生成CO和H2的热化学方程式____________。
(2)汽车尾气的排放是大气污染物的重要来源,其中含有NO气体。根据资料显示用活性炭还原法可以处理氮氧化物,某硏究小组向固定容积的密闭容器中加入一定量的活性炭和NO发生反应C(s)+2NO(g)![]() CO2(g)+N2(g) △H=-574kJ·mol-1,并在温度T时将所测反应数据制成下表:
CO2(g)+N2(g) △H=-574kJ·mol-1,并在温度T时将所测反应数据制成下表:
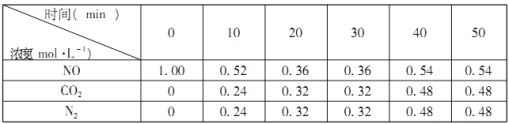
①0到10min内,NO的平均反应速率v(NO)=___________mol·L-1·min-1。
②下列数据不再变化可表示该反应达到平衡的是________________________。
a.容器内压强 b.混合气体的平均摩尔质量 c.混合气体的密度
③若容器改为可变容积容器,达平衡后,再充入少量NO气体,再次达到平衡时N2的浓度 ____________(填“增大”,“减小”,或“不变”)
(3)在某温度T时能同时发生反应:
2N2O5(g)![]() 2N2O4(g)+O2(g) K1
2N2O4(g)+O2(g) K1
N2O4(g)![]() 2NO2(g) K2
2NO2(g) K2
若向一体积固定为2L的密闭容器内加入N2O5 2mol,一段时间后,容器内的反应达到平衡,此时n(NO2)=0.4mol,已知K2=0.1,请计算出K1=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 因为NH3·H2O是弱碱,所以不能用氨水与FeCl3溶液反应制取Fe(OH)3
B. 向FeI2溶液中通入少量Cl2,再滴加少量CCl4,振荡、静置,下层液体为紫色
C. 向一定体积的热浓硫酸中加入足量的铁粉,生成的气体能被烧碱溶液完全吸收
D. 将SO2气体通入溴水,欲检验是否有SO42-生成,可向溶液中滴加Ba(NO3) 2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )

A.甲、乙、丙三物质转化如图所示,则![]()
B.1molCO完全燃烧生成稳定氧化物放出热量为![]() ,则2
,则2 ![]()
![]() ,
,![]()
C.若![]() ,
,![]() ,故在某容器中充入
,故在某容器中充入![]() 与
与![]() 充分反应后,放出的热量为
充分反应后,放出的热量为![]()
D.常温下,稀HCl和稀NaOH溶液反应生成![]() 放出热量为
放出热量为![]() ,其热化学方程式为
,其热化学方程式为![]() ,
,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由U形管、质量为mg的铁棒、质量为mg的碳棒和1L0.2mol·L-1CuCl2溶液组成如图所示装置,下列说法不正确的是( )

A. 打开K,铁棒上有紫红色物质析出
B. 闭合K,碳棒上有紫红色固体析出
C. 闭合K,碳棒表面发生的电极反应为Cu2++2e-=Cu
D. 闭合K,当电路中有0.3NA个电子通过时,理论上碳棒与铁棒的质量差为9.6g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com