
【题目】化学与生活、能源、环境等密切相关。下列叙述正确的是( )
A.油脂和蛋白质是人体必需的营养物质,都属于高分子化合物
B.食品包装袋中常有硅胶、生石灰、还原铁粉等,其作用都是吸水防止食品变质
C.采用催化转化技术,可将汽车尾气中的一氧化碳和氮氧化物转化为无毒气体
D.中医古籍![]() 肘后备急方
肘后备急方![]() 中“青蒿一握,以水二升渍,绞取汁,尽服之”启发了屠呦呦采用低温提取青蒿素,该提取过程属于化学变化
中“青蒿一握,以水二升渍,绞取汁,尽服之”启发了屠呦呦采用低温提取青蒿素,该提取过程属于化学变化
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】四氯化锡(SnCl4)常用于染色的媒染剂等,工业上常用氯气与金属锡反应制备四氯化锡,某研究性学习小组在实验室用以下装置模拟四氯化锡的制备(夹持装置略)。

已知:①金属锡熔点为231℃,化学活泼性与铁相似。
②SnCl4为无色液体,熔点-33℃,沸点114℃,极易水解生成SnO2·xH2O,在潮湿的空气中发烟。
③SnCl2中的Sn2+易被氧化为Sn4+。
请回答下列问题:
(1)仪器F的名称是_______________,装置B中的试剂是_____________(填名称)。
(2)实验前应先点燃_________(填“A”或“E”)处的酒精灯,待__________(填实验现象)后,再点燃另外一处的酒精灯。
(3)若没有装置C(其他均相同),则D中发生的主要副反应的化学方程式为__________。
(4)该实验装置存在设计缺陷,你的改进措施为______________________________。
(5)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):取0.7500g锡粉溶于足量稀盐酸中,向生成的SnCl2溶液中加入过量的FeCl3溶液,用物质的量浓度为0.1000molL-1 K2Cr2O7标准溶液滴定生成的Fe2+(已知酸性环境下Cr2O72-可被还原为Cr3+),共用去K2Cr2O7溶液的体积为20.00mL。
①锡粒中锡的质量分数_____。
②若溶解锡粉的过程生成的SnCl2溶液中含有Sn![]() ,则测定结果将__________(填“偏高”、“偏低”或“无影响”)
,则测定结果将__________(填“偏高”、“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应进行过程中,各物质物质的量的变化情况如图所示。下列说法正确的是
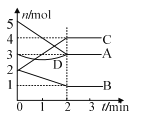
A. C、D是生成物
B. 反应的方程式为2A + B![]() 2C
2C
C. 2 min后各物质的量不再变化
D. 该反应不是可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过测定反应过程中所放出的热量可计算中和热。50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在图示的装置中进行中和反应.回答下列问题:
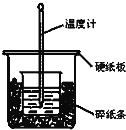
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是___________.
(2)大烧杯上如果不盖硬纸板,求得的中和热数值__________(填“偏大”,“偏小”或“无影响”).
(3)实验中改用60mL 0.50mol/L盐酸跟50mL 0.55mol/LNaOH溶液进行反应,与上述实验相比,所求中和热________(填“相等”“不相等”),简述理由:______________________.
(4)若两溶液的密度都是1g/mL,中和后所得溶液的比热容c=4.18J/(g·℃),三次平行操作测得终止温度与起始温度差(t2﹣t1)分别为:①3.2℃ ②2.2℃ ③3.0℃,写出表示盐酸与NaOH溶液反应的中和热的热化学方程式________________________.(小数点后保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱厂电解饱和食盐水制取的工艺流程图如下:
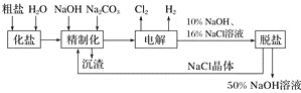
(1)在电解过程中,与电源正极相连的电极上所发生反应的电极反应式为______________,与电源负极相连的电极上所发生反应的电极反应式为__________________。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程中发生反应的离子方程式为________________________________________________________________________。
(3)如果粗盐中![]() 含量较高,必须添加钡试剂除去
含量较高,必须添加钡试剂除去![]() ,该钡试剂可以是______(填字母)。
,该钡试剂可以是______(填字母)。
a、Ba(OH)2 b、Ba(NO3)2 c、BaCl2
(4)为有效除去Ca2+、Mg2+、![]() ,加入试剂的合理顺序为________。
,加入试剂的合理顺序为________。
a、先加NaOH,后加Na2CO3,再加钡试剂
b、先加NaOH,后加钡试剂,再加Na2CO3
c、先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过________、冷却、结晶、________(填写操作名称)除去NaCl。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸铵是一种常用的化肥,其工业生产流程如图,请回答下列问题。
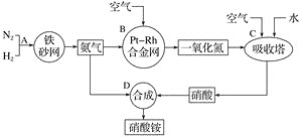
(1)写出反应容器B中发生反应的化学方程式:____。
(2)吸收塔C中通入空气的目的是___;C、D两个反应容器中发生的反应,属于氧化还原反应的是___(填反应容器代号)。
(3)浓硝酸一般保存在棕色试剂瓶里,并放置在阴凉处,用化学方程式解释原因:___。
(4)碳与浓硝酸反应的化学方程式是_____。
(5)将128g铜置于一定量的浓硝酸中并微热。当铜片完全消失时,共收集到NO2和NO的混合气体44.8L(标准状况)。
①写出上述过程中,有关反应的离子方程式:____、____。
②完成该反应至少需要量取10mol·L-1的浓硝酸_____mL。
③混合气体中NO2的体积为____L,NO的体积为____L(均为标准状况下)。
④将收集上述气体的容器倒扣在盛有水的水槽中,并向其中缓慢通入O2使其充分反应,若要使溶液恰好充满容器,则理论上需要参加反应的O2的物质的量为____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂排出的废水中含有大量的Fe2+、Cu2+和SO42-。
Ⅰ.某校研究性学习小组设计下图工艺流程以回收铜和硫酸亚铁。请回答:

(1)加入原料①反应的离子方程式为_____
(2)操作①中用到的玻璃仪器是_____(填序号)。
a.烧杯 b.漏斗 C.玻璃棒 d.酒精灯
(3)加入原料②的名称为_____
Ⅱ.回收的铜可用于制备胆矾(CuSO45H2O)。将铜和一定浓度稀硫酸混合后在加热的情况下通入氧气,发生如下反应:2Cu+2H2SO4+O2═2CuSO4+2H2O,制得硫酸铜溶液后,经过蒸发浓缩冷却结晶、过滤可得胆矾
(1)请分析2Cu+2H2SO4+O2![]() 2CuSO4+2H2O反应中,氧化剂是_____氧化产物是_____(填化学式)
2CuSO4+2H2O反应中,氧化剂是_____氧化产物是_____(填化学式)
(2)用双线桥标出反应中电子转移的方向和数目______________________
(3)若有147gH2SO4参与反应,则反应转移的电子数目为_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应3BrF3+5H2O===HBrO3+Br2+9HF+O2↑中,若有5 mol H2O作为还原剂时,被还原的BrF3的物质的量为( )
A. 3 mol B. 2 mol C. ![]() mol D.
mol D. ![]() mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷对水体的污染情况越来越受到人们的重视。回答下列问题:
(1)常温下,在pH约为9时,用澄清石灰水可将水体中的HPO42-化为Ca10(PO4)6(OH)2沉淀除去,该反应的离子方程式为_____________。
(2)除去地下水中的硝态氮通常用还原剂将其还原为N2。
①Prusse等提出的用Pd-Cu作催化剂,常温下,在pH为4.0~6.0时,可直接用H2将NO3-还原为N2,该反应的离子方程式为__________。研究发现用H2和CO2的混合气体代替H2,NO3-的去除效果比只用H2时更好,其原因是________。
②在pH约为5时,用纳米Fe粉可将NO3-还原为N2,Fe粉被氧化为Fe2+,该反应中氧化产物与还原产物的物质的量之比为_________。
(3)实验测得相同条件下,用次氯酸钠脱除水体中的氨态氮的过程中(2NH3+3ClO-=N2+3H2O+3Cl-),pH与氨态氮的去除率关系如图所示,在pH大于9时,pH越大,去除率越小,其原因是_________。
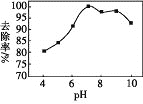
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com