
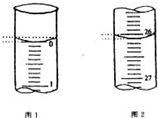
 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L 盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.10 | 26.10 |
| 第二次 | 25.00 | 1.56 | 28.08 | 26.52 |
| 第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
分析 (1)酸碱中和滴定时,眼睛要注视锥形瓶内溶液的颜色变化;滴定终点时溶液颜色由红色突变为无色;
(2)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
(3)根据滴定管的结构和精确度以及测量的原理;
(4)先判断数据的合理性,然后盐酸溶液的平均体积,然后根据HCl~NaOH求氢氧化钠的物质的量浓度.
解答 解:(1)酸碱中和滴定时,眼睛要注视锥形瓶内溶液的颜色变化,滴定终点时溶液颜色由红色突变为无色,且半分钟内不褪色;
故答案为:锥形瓶内溶液颜色的变化;溶液颜色由红色突变为无色,且半分钟内不褪色;
(2)A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,测定c(待测)偏大,故A错误;
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,测定c(待测)无影响,故B错误;
C.酸式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,测定c(待测)偏大,故C错误;
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,测定c(待测)偏小,故D正确;
故选D;
(3)起始读数为0.00mL,终点读数为26.10mL,盐酸溶液的体积为26.10mL,
故答案为:0.00;26.10;26.10;
(4)三次消耗的盐酸的体积为26.10mL,26.52mL,26.12mL,第二次舍去,其他两次溶液的平均体积为26.11mL,NaOH溶液的体积为25.00mL,
HCl~NaOH
1 1
0.1000mol•L-1×26.11mL C(NaOH)×25.00mL
解得:C(NaOH)=0.1044mol/L;
故答案为:0.1044mol/L.
点评 本题主要考查了中和滴定操作、误差分析以及计算,难度不大,理解中和滴定的原理是解题关键.


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案科目:高中化学 来源: 题型:选择题
| A. | NF3中N呈+3价 | B. | NF3是共价化合物 | ||
| C. | NF3的氧化性比F2强 | D. | NF3分子呈三角锥形 |
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:填空题
根据描述写出正确的化学方程式或离子方程式
(1)工业制取漂白粉_________________________________
(2)实验室制取氯气____________________________
(3)往碳酸氢钠溶液中滴加少量的氢氧化钙溶液_________________________
(4)向硫酸氢钠溶液中滴加氢氧化钡溶液至溶液呈中性___________________
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:选择题
下列叙述正确的是( )
A.向含有 CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,又有CaCO3沉淀生成
B.向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1∶2
C.等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同
D.向Na2CO3饱和溶液中通入CO2,有NaHCO3结晶析出
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:选择题
下列各组中的两种物质作用时,反应条件(温度?反应物用量比)改变,不会引起产物的种类改变的是( )
A.Na和O2 B.NaOH和CO2
C.Na2O2和CO2 D.NaHCO3和Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.50 | 25.40 |
| 第二次 | 20.00 | 4.00 | 29.10 |
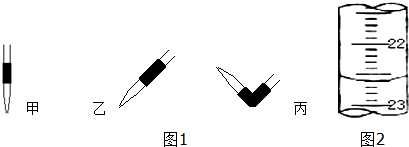
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
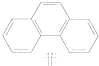
| A. | 丙烷的一氯代物有2种,丙烷的二氯代物有4种 | |
| B. | 分子式为C8H10,且属于芳香族化合物的同分异构体只有3种 | |
| C. | 菲的结构简式如右图,它与硝酸反应,所得一硝基取代物有5种 | |
| D. | 甲苯苯环上的一个氢原子被一C3H7取代,所得有机产物有6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
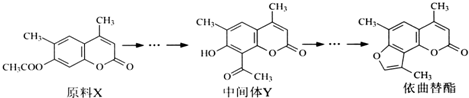
| A. | X与Y互为同分异构体 | |
| B. | 可用酸性KMnO4溶液鉴别X和Y | |
| C. | 1molY能与6molH2或3mol NaOH发生反应 | |
| D. | 依曲替酯只能发生加成、取代、消去反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com