
| A. | NF3中N呈+3价 | B. | NF3是共价化合物 | ||
| C. | NF3的氧化性比F2强 | D. | NF3分子呈三角锥形 |
分析 A、NF3中F呈-1价;
B、NF3中只有共价键形成的化合物;
C、氧化剂的氧化性制强于产物的氧化性;
D、NF3分子中氮是sp3杂化,周围有一对孤对电子对.
解答 解:A、NF3中F呈-1价,根据化合价代数和为0,所以N呈+3价,故A正确;
B、NF3中只有共价键形成的化合物,故B正确;
C、氧化剂的氧化性制强于产物的氧化性,在反应4NH3+3F2═NF3+3NH4F中F2是氧化剂,而NF3是氧化产物,所以NF3的氧化性比F2弱,故C错误;
D、NF3分子中氮是sp3杂化,周围有一对孤对电子对,所以NF3分子呈三角锥形,故D正确;
故选C.
点评 本题考查了元素化合价的变化、氢键、分子的空间构型、晶体类型的判断,题目难度不大,侧重于基础知识的考查.


科目:高中化学 来源: 题型:选择题
| A. | Na+ K+ OH- Cl- | B. | Na+ Cu2+ SO42- NO3- | ||
| C. | K+ Na+ SO42- Cl- | D. | Ba2+ CO32- NO3- K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 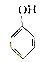 | B. | CH2═CH-Cl | ||
| C. | 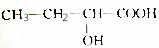 | D. | HO(CH2)4COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8种 | B. | 16种 | C. | 36种 | D. | 44种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 的有机物分子1mol,与NaOH溶液混合并水浴加热,完全反应后,消耗NaOH的物质的量为( )
的有机物分子1mol,与NaOH溶液混合并水浴加热,完全反应后,消耗NaOH的物质的量为( )| A. | 1mol | B. | 2mol | C. | 3mol | D. | 4mol |
查看答案和解析>>
科目:高中化学 来源:2017届湖北省荆门市高三上九月联考化学试卷(解析版) 题型:实验题
用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如下:
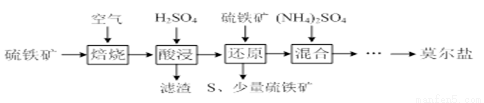
已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ如下:
2Fe3++ FeS2=2S↓+3Fe2+
(1)“还原”时,pH不宜过高的原因是____________,写出“还原”时反应Ⅱ的离子方程式:___________。
(2)实验测得“还原”时反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比为2:7。计算“还原”后溶液Fe2+的浓度即可确定后面所加(NH4)2SO4的量(溶液体积变化忽略不计)。
离子 | 离子浓度(mol·L-1) | |
还原前 | 还原后 | |
SO42- | 3.2 | 3.5 |
Fe2+ | 0.15 | |
(3)称取23.52g新制莫尔盐,溶于水配成溶液并分成两等份。一份加入足量的BaCl2溶液,得到白色沉淀13.98g;另一份用0.2000mol/LK2Cr2O7酸性溶液滴定,当Cr2O72-恰好完全被还原为Cr3+时,消耗溶液的体积为25.00mL。试确定莫尔盐的化学式__________。
查看答案和解析>>
科目:高中化学 来源:2017届河南省开封市高三上学期10月定位考试化学试卷(解析版) 题型:选择题
为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
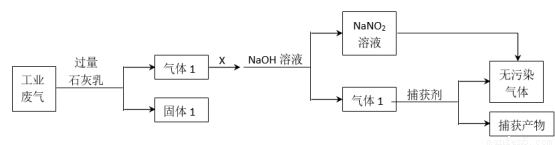
下列说法错误的是
A.固体1中主要含有Ca(OH)2、CaCO3、CaSO3
B.X可以是空气,且需过量
C.捕获剂所捕获的气体主要是CO
D.处理含NH4+废水时,发生反应的离子方程式为:NH4++NO2-=N2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
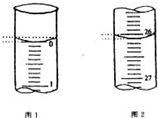 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L 盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.10 | 26.10 |
| 第二次 | 25.00 | 1.56 | 28.08 | 26.52 |
| 第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com