
【题目】下列有关化学键与晶体结构说法正确的是( )
A. 两种元素组成的分子中一定只有极性键
B. 离子化合物的熔点一定比共价化合物的高
C. 非金属元素组成的化合物一定是共价化合物
D. 含有阴离子的化合物一定含有阳离子
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
①活化分子间的碰撞一定能发生化学反应 ②普通分子间的碰撞有时也能发生化学反应 ③一般说来,活化分子比普通分子具有更高的能量 ④化学反应的实质是原子的重新组合 ⑤化学反应的实质是旧化学键断裂和新化学键形成的过程 ⑥化学反应的实质是活化分子有合适取向时的有效碰撞
A.①③④⑤ B.②③⑥ C.③④⑤⑥ D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应aA(g)+bB(g)![]() cC(g)(△H<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图
cC(g)(△H<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图

回答问题:
(1)反应的化学方程式中,a:b:c为________;
(2)A的平均反应速率VI(A)、vII(A)、vIII(A)从大到小排列次序为________;
(3)B的平衡转化率aI(B)、aII(B)、aIII(B)中最小的是_________;
(4)由第一次平衡到第二次平衡,平衡移动的方向是_______________;
(5)比较第II阶段反应温度(T2)和第III阶段反应温度(T3)的高低:T2___T3(填“>、=、<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上主要利用碳热还原重晶石制得硫化钡,进而生产各种钡化合物。下图为不同反应温度下,实验中碳热还原硫酸钡反应体系的平衡组成随反应温度的变化关系。下列说法正确的是
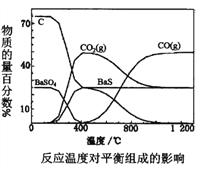
A. 约150℃,体系中开始出现BaS,说明温度越高反应速率越快
B. 400℃时发生的化学反应方程式: BaSO4+2C![]() BaS+2CO2
BaS+2CO2
C. CO—定无法还原重晶石
D. 温度高于400℃后,硫酸钡才能转化为BaS
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中,吸收的热量用于克服分子间作用力的是( )
A. 液氨受热蒸发 B. 加热金属铝使之熔化
C. 加热食盐晶体使之熔化 D. 加热硅晶体使之熔化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素最高价氧化物对应的水化物的化学式是H2XO3,这种元素的气态氢化物的化学式为( )
A. HX B. H2X C. XH3 D. XH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析细胞内4种重要有机物的组成及功能,回答下列问题:

(1)A一般是指______;E在动物细胞中是指________
(2)F是指________;除此之外,脂质还包括磷脂和________两大类。
(3)C的结构通式是_________,[G]是指________,C形成[G]的过程叫______________。
(4)构成人体的遗传物质的中文全称是________________,如果碱基是T,则D的全称是_________。如果碱基是U,则D的全称是_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尿素(NH2CONH2)是目前含氮量最高的氮肥。国内外主要以NH3和CO2为原料进行合成。主要通过以下二个反应进行:
第一步:2NH3(l)+CO2(g)![]() H2NCOONH4(l) △H1=-117.2kJ·mol-1
H2NCOONH4(l) △H1=-117.2kJ·mol-1
第二步:H2NCOONH4(l)![]() H2O(l)+H2NCONH2(l) △H2=+21.7kJ·mol-1
H2O(l)+H2NCONH2(l) △H2=+21.7kJ·mol-1
请回答:
(1)己知:NH3(l)![]() NH3(g) △H3 = ckJ·mol-1。火电厂烟气脱硝所使用的还原剂氨气主要来自于尿素水解。则反应NH2CONH2(l)+H2O(l)
NH3(g) △H3 = ckJ·mol-1。火电厂烟气脱硝所使用的还原剂氨气主要来自于尿素水解。则反应NH2CONH2(l)+H2O(l)![]() 2NH3(g)+CO2(g)的 △H4=_________kJ·mol-1 (用含c的式子表示),该反应能在常温下缓慢发生的主要原因是__________________。
2NH3(g)+CO2(g)的 △H4=_________kJ·mol-1 (用含c的式子表示),该反应能在常温下缓慢发生的主要原因是__________________。
(2)①一定条件下,n(NH3)/n(CO2)对NH2COONH4的平衡转化率会产生明显的影响,如图1所示。NH2COONH4的平衡转化率随n(NH3)/n(CO2)增大而上升,试分析其原因:_______________。

②恒温密闭容器中,一定量的NH3和CO2反应合成尿素,第10 min达到平衡。若相同条件下反应1的速率要快于反应2,请在图中画出0~15min内,NH2COONH4的物质的量浓度随时间变化曲线____________。

③下图表示不同条件下,反应:N2(g) +3H2(g)![]() 2NH3(g)的产物浓度随时间的变化曲线。
2NH3(g)的产物浓度随时间的变化曲线。
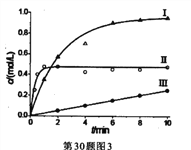
下列有关说法中,正确的是____________。
A.达到平衡时间最快的是II
B.反应约10分钟后,三个反应均己达到平衡
C.I条件下氢气的平衡转化率大于Ⅱ
D.三个反应的平衡常数一定相同
(3)用电化学方法可以实现低温常压合成氨。下图是以含N3-熔融盐为电解质,电解合成氨装置的工作原理示意图。阴极的电极反应是_______________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com