
【题目】决定物质性质的重要因素是物质结构。请回答下列问题:
(1)基态K原子中,核外电子占据最高能层的符号是_______,占据该能层电子的电子云轮廓图形状为______________。
(2)已知元素M是组成物质![]() 的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号
的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号![]() 至
至![]() 表示)如表所示:
表示)如表所示:
|
|
|
|
| |
电离能 | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
元素M化合态常见化合价是_________价,其基态原子电子排布式为_______
(3)![]() 的中心原子的杂化方式为__________,键角为____________
的中心原子的杂化方式为__________,键角为____________
(4)![]() 中非金属元素电负性由大到小的顺序为_____________
中非金属元素电负性由大到小的顺序为_____________
(5)下列元素或化合物的性质变化顺序正确的是_______________
A.第一电离能:![]() B.共价键的极性:
B.共价键的极性:![]()
C.晶格能:![]() D.热稳定性:
D.热稳定性:![]()
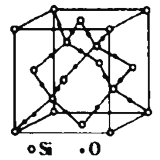
(6)如图是![]() 晶胞,构成二氧化硅晶体结构的最小环是由________个原子构成。已知晶胞参数为
晶胞,构成二氧化硅晶体结构的最小环是由________个原子构成。已知晶胞参数为![]() ,则其晶胞密度为________
,则其晶胞密度为________![]() 。
。
【答案】N 球形 +2 1s22s22p63s23p64s2或[Ar] 4s2 sp3 109°28′ F>O>P BC 12 ![]()
【解析】
(1)基态K原子共有4给电子层,最高能层位N;价层电子排布式为4s1;
(2) M的第三电离能远远大于第二电离能,该元素最外层有2个电子;
(3)根据价层电子互斥理论确定![]() 杂化方式及空间构型;
杂化方式及空间构型;
(4)Ca3(PO4)3F中非金属元素为P、O、F,同周期主族元素自左而右电负性增大,同主族自上而下电负性减小;
(5) A. 同周期元素的第一电离能有增大的趋势,价层电子处于充满或半充满状态时,第一电离能大于其后元素的;
B.键合原子的电子亲合能或电负性的差值越大,极性越大;
C. 离子半径越小,键长越短,晶格能越大;
D. 金属阳离子的半径越小,其碳酸盐的热稳定性越弱;
(6)构成二氧化硅晶体结构的最小环是六元环,根据密度公式![]() 计算晶体密度。
计算晶体密度。
(1)基态K原子共有4给电子层,最高能层位N;价层电子排布式为4s1,该能层电子云轮廓为球形,故答案为:N;球形;
(2) M的第三电离能远远大于第二电离能,说明该元素失去2个电子时为稳定结构,则该元素最外层有2个电子,则M为Ca,元素M化合态常见化合价是+2,其基态原子电子排布式为:1s22s22p63s23p64s2或[Ar] 4s2,故答案为:+2;1s22s22p63s23p64s2或[Ar] 4s2;
(3)![]() 的中心原子P的孤电子对数为:1/2(a-xb)=1/2(5+3-2×4)=0,价层电子对数为:4+0=4,P原子杂化方式为sp3杂化,空间构型为正四面体,键角为109°28′,故答案为:sp3;109°28′;
的中心原子P的孤电子对数为:1/2(a-xb)=1/2(5+3-2×4)=0,价层电子对数为:4+0=4,P原子杂化方式为sp3杂化,空间构型为正四面体,键角为109°28′,故答案为:sp3;109°28′;
(4)Ca3(PO4)3F中非金属元素为P、O、F,同周期主族元素自左而右电负性增大,同主族自上而下电负性减小,所以电负性:F>O>P,故答案为:F>O>P;
(5) A. 同周期元素的第一电离能有增大的趋势,价层电子处于全充满或半充满状态时,第一电离能大于其后元素的第一电离能,则Cl>P>S>Si,A错误;
B.键合原子的电子亲合能或电负性的差值越大,极性越大,则共价键的极性:HF>HCl>HBr>HI,B正确;
C. 离子半径越小,键长越短,晶格能越大,则晶格能:NaF>NaCl>NaBr>NaI,C正确;
D. 金属阳离子的半径越小,其碳酸盐的热稳定性越弱,则热稳定性:BaCO3>SrCO3>CaCO3>MgCO3,D错误;故答案为:BC。
(6)构成二氧化硅晶体结构的最小环是六元环,其中有6个Si原子和6个O原子,所以构成二氧化硅晶体结构的最小环是由12个原子构成;1个晶胞中含有Si原子的数目为:8×1/8+6×1/2+4=8,含有O原子的数目为:16,则根据公式:![]() ,其晶胞的密度为:
,其晶胞的密度为:
![]() ,故答案为:12;
,故答案为:12;![]() 。
。


科目:高中化学 来源: 题型:
【题目】![]() 温度下,向
温度下,向![]() 的密闭容器中充入
的密闭容器中充入![]() ,在催化剂作用下发生反应:
,在催化剂作用下发生反应:![]() (未配平),反应过程中部分数据如图所示,下列说法正确的是( )
(未配平),反应过程中部分数据如图所示,下列说法正确的是( )
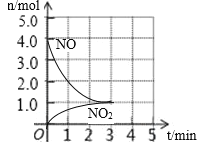
A.![]() 可能为
可能为![]()
B.![]() 用
用![]() 表示的反应速率为
表示的反应速率为![]()
C.![]() 温度下,反应的平衡常数为2.0
温度下,反应的平衡常数为2.0
D.![]() 温度下,保持体积不变,往容器中再通入少量
温度下,保持体积不变,往容器中再通入少量![]() 气体,
气体,![]() 的体积分数变大
的体积分数变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为铝热反应的实验装置,请回答下列问题:

(1)该实验装置中还缺________,引发铝热反应的操作为_______。
(2)若将氧化铁换成氧化镁,该反应____(填“能”或“不能”)发生,理由是______。
(3)铝热反应的用途有哪些__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是药物合成的一种中间体,可通过以下方法合成:

(1)B中官能团名称为_____________。
(2)G→H的反应类型为__________。
(3)已知C的一种同分异构体为: ,下列说法正确的是____________。
,下列说法正确的是____________。
a.能发生酯化反应
b.能发生银镜反应
c.1mol该物质完全水解能消耗3mol NaOH
d.该分子的核磁共振氢谱中峰面积之比为1∶2∶6∶2
e.其在酸性条件下的水解产物之一能与FeCl3溶液发生显色反应
(4) 中手性碳原子(一个碳原子上连有4个不一样的原子或者原子团)个数为________。
中手性碳原子(一个碳原子上连有4个不一样的原子或者原子团)个数为________。
(5)E的分子是为C14H17O3N,E经还原得到F,写出E→F的反应方程式:_______。
(6)已知:①
![]()

![]()

②苯胺( )易被氧化。请以甲苯和(CH3CO)2O为原料制备
)易被氧化。请以甲苯和(CH3CO)2O为原料制备![]() ,写出制备的合成路线流程图(无机试剂任选)。_________。
,写出制备的合成路线流程图(无机试剂任选)。_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气,将多余的氯气用100 mL 1.7mol/L的NaOH溶液完全吸收。对吸收后的溶液进行分析化验,测知c(OH-)=0.1mol/L (不考虑反应前后溶液的体积变化) 。ClO-和ClO3-的物质的量浓度之比为5∶1。请回答:
(1)吸收氯气消耗的NaOH的物质的量为_______________mol。
(2)被氧化的氯气的物质的量为_______________mol,被还原的氯气的物质的量为 _______________mol。
(3)若采用二氧化锰和浓盐酸共热的方法制氯气,制备尾气中的氯气所消耗的二氧化锰的质量为_______________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
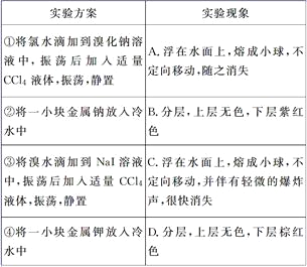
【题目】某同学做同主族元素性质相似性、递变性实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系)。
请你帮助该同学整理并完成实验报告。
(1)实验目的:_____________________。
(2)实验用品:
①试剂:金属钠、金属钾、新制氯水、溴水、0.1mol·L-1溴化钠溶液、0.1 mol·L-1碘化钠溶液、四氯化碳等;
②仪器:________、________、________、镊子、小刀、玻璃片等。
(3)实验内容(填写与实验方案对应的实验现象的标号和化学方程式):________

(4)实验结论:__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有氯化钠和碘化钠的混合物共26.7 g,溶于水,通入足量氯气后,蒸干、灼烧,固体质量变为 17.55 g。
(1)原混合物中碘化钠的质量是________。
(2)原混合物中氯化钠的质量分数是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是
A. 用CCl4提取溴水中的Br2
用CCl4提取溴水中的Br2
B. 除去乙醇中的四氯化碳
除去乙醇中的四氯化碳
C. 从KI和I2的固体混合物中回收I2
从KI和I2的固体混合物中回收I2
D. 配制100mL 0.1000molL-1的NaCl溶液
配制100mL 0.1000molL-1的NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L的恒容容器中,充入1 mol A和3 mol B,并在一定条件下发生如下反应:A(s)+3B(g)![]() 2C(g),若经3 s后测得C的浓度为0.6 mol·L-1,下列选项说法正确的组合是( )
2C(g),若经3 s后测得C的浓度为0.6 mol·L-1,下列选项说法正确的组合是( )
①用B表示的反应速率为0.4 mol·L-1·s-1
②3 s时生成C的物质的量为1.2 mol
③3 s时B的浓度为0.6 mol·L-1
A. ①②B. ①③
C. ②③D. ①②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com