
【题目】下图中,甲、乙、丙、丁分别代表相应物质与水发生的化学反应。回答下列问题:
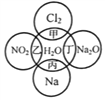
(1)甲、乙、丙、丁中,不属于氧化还原反应的是______________(用甲乙丙丁填空,下同),属于置换反应的是____________。
(2)写出丁反应中产物的化学式:______________,写出甲反应的化学方程式:________________________________。
科目:高中化学 来源: 题型:
【题目】硼和氮的单质及一些化合物在工农业生产等领域有重要应用。回答下列问题。
(1)N原子核外有___种不同运动状态的电子。基态N原子中,能量最高的电子所占据的原子轨道的形状为___________。
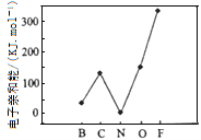
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是_______________________;氮元素的E1呈现异常的原因是_______________________。
(3)经测定发现,N2O5固体由NO2+和NO3-两种离子组成,该固体中N原子杂化类型为___________________。
(4)铵盐大多不稳定。NH4F、NH4I中,较易分解的是____,原因是__________________。
(5)第二周期中,第一电离能介于B元素和N元素间的元素为_____(填“元素符号”)。
(6)已知:①NO2 + CO ![]() CO2 + NO
CO2 + NO
每1mol下列物质分解为气态基态原子消耗能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+179.5 kJ/mol
2NO(g) ΔH=+179.5 kJ/mol
③2NO(g) +O2(g)![]() 2NO2(g) ΔH=-112.3 kJ/mol
2NO2(g) ΔH=-112.3 kJ/mol
试写出NO与CO反应生成无污染物气体的热化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:

(1)该“84消毒液”的物质的量浓度约为___________molL-1(取整数)。
(2)某同学取100mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=_________molL-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数为25%的消毒液。下列说法正确的是________(填序号)。
A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器

B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0g
(4)若实验遇下列情况,则所配溶液的物质的量浓度是:
A、偏高 B、偏低 C、不变(用符号回答)
Ⅰ.定容时俯视刻度线:__________。
Ⅱ.未冷至室温就转移定容:__________。
Ⅲ.转移前,容量瓶内有蒸馏水:___________。
Ⅳ.定容时水多用胶头滴管吸出:____________。
(5)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84gcm-3)的浓硫酸配制2000mL2.3molL-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为________molL-1。
②需用浓硫酸的体积为________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)盐酸中加入六次甲基四胺对钢铁有一定缓蚀作用,右图为其结构简式,其分子式为(CH2)6N4,其中碳原子采用___________杂化,其缓蚀作用是因为分子中___________原子的孤对电子能与铁原子形成配位键,覆盖在钢铁表面。

(2)CO与N2属于等电子体,1个CO分子中含有的π键数目是___________个。
C、N、O三种元素的笫一电离能最大的是___________。
(3)右图是某化合物的晶胞示意图,硅原子与铝原子之间都以共价键连接。

①该化合物的化学式是___________。
②Si元素基态原子的电子排布式是___________。
③已知晶胞边长为5.93×10-8cm,Si与A1之间的共价键键长是___________cm(只要求列算式,不必计算出数值,下同),晶体的密度是___________g·cm-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是( )
A.光导纤维是以二氧化硅为主要原料制成的
B.二氧化硅溶于水生成硅酸
C.石英、水晶、玛瑙的主要成分都是二氧化硅
D.二氧化硅是一种熔沸点很高、硬度很大的氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是( )
A. Ⅰ中气体由无色变红棕色的化学方程式:2NO+O2═2NO2
B. Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对此Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需用450 mL3.0 mol·L-1 H2SO4溶液,某同学用98%的浓硫酸 (密度为1.84 g/mL)按下列步骤来配制。
(1)请回答有关问题。
实验步骤 | 有关问题 |
a.计算所需浓H2SO4的体积; | 量取浓H2SO4的体积为①__________ |
b.量取浓硫酸; | |
c.将浓H2SO4慢慢加入到装有蒸馏水的200 mL烧杯中; | |
d.将烧杯中的溶液冷却后转移至②__________中; | |
e.洗涤后,向容量瓶中加蒸馏水距刻度线1~2cm,改用③__________定容。 |
(2)配制H2SO4溶液时,若出现下列操作,其结果偏高还是偏低?
A.量取浓H2SO4溶液时仰视读数 ____;
B.定容时仰视刻度线 ___;
C.浓硫酸溶于水后未经冷却就转移____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2-丁烯有顺、反两种异构体,在其条件下可种气体处于平衡,

 (g)+H2(g)→CH3CH2CH2CH3(g) △H=-118.9kJ/mol;
(g)+H2(g)→CH3CH2CH2CH3(g) △H=-118.9kJ/mol;
下列说法正确的是
A. 顺-2-丁烯比反-2-丁烯稳定
B. 加压和降温有利于平衡向生成顺-2- 丁烯反应方向移动
C. .顺-2-丁烯的燃烧热比反-2-丁烯小
D. 反-2-丁烯氢化的热化学方程式为 (g)+H2(g)→CH3CH2CH2CH3(g) △H=-114.7kJ/mol
(g)+H2(g)→CH3CH2CH2CH3(g) △H=-114.7kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com