
【题目】硼和氮的单质及一些化合物在工农业生产等领域有重要应用。回答下列问题。
(1)N原子核外有___种不同运动状态的电子。基态N原子中,能量最高的电子所占据的原子轨道的形状为___________。
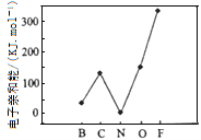
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是_______________________;氮元素的E1呈现异常的原因是_______________________。
(3)经测定发现,N2O5固体由NO2+和NO3-两种离子组成,该固体中N原子杂化类型为___________________。
(4)铵盐大多不稳定。NH4F、NH4I中,较易分解的是____,原因是__________________。
(5)第二周期中,第一电离能介于B元素和N元素间的元素为_____(填“元素符号”)。
(6)已知:①NO2 + CO ![]() CO2 + NO
CO2 + NO
每1mol下列物质分解为气态基态原子消耗能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+179.5 kJ/mol
2NO(g) ΔH=+179.5 kJ/mol
③2NO(g) +O2(g)![]() 2NO2(g) ΔH=-112.3 kJ/mol
2NO2(g) ΔH=-112.3 kJ/mol
试写出NO与CO反应生成无污染物气体的热化学方程式_________________。
【答案】 七(或“7”) 哑铃形(或纺锤形) 根据图(a),同周期随着核电荷数依次增大,原子半径逐渐变小,故结合一个电子释放出的能量依次增大 氮元素的2p能级达到半满状态,原子相对稳定,不易失去电子 sp、sp2 NH4F F原子半径比I原子小,H→F键比H→I键强(H→F更易形成),F-更易夺取NH4+中的H+ Be、C、O ![]()
![]()
【解析】(1). N是7号元素,核外有7种不同运动状态的电子,N原子的核外电子排布式为1s22s22p3,在基态N原子中,能量最高的电子所占据的原子轨道是2p,形状为哑铃形(或纺锤形),故答案为:七(或“7”);哑铃形(或纺锤形);
(2). 根据图(a)可知,同周期元素随着核电荷数依次增大,原子半径逐渐变小,吸引电子的能力逐渐增强,故结合一个电子释放出的能量依次增大,故答案为:根据图(a),同周期随着核电荷数依次增大,原子半径逐渐变小,故结合一个电子释放出的能量依次增大;
(3). 经测定发现,N2O5固体由NO2+和NO3-两种离子组成,NO2+的价层电子对数为:2+![]() =2,NO3-的价层电子对数为:3+
=2,NO3-的价层电子对数为:3+![]() =3,所以该固体中N原子杂化类型为sp、sp2,故答案为:sp、sp2;
=3,所以该固体中N原子杂化类型为sp、sp2,故答案为:sp、sp2;
(4). F和I属于同一主族元素,因F原子半径比I原子小,非金属性F>I,所以H→F键比H→I键更强,H→F键比H→I键更易形成,F-更易夺取NH4+中的H+,所以NH4F、NH4I中,较易分解的是NH4F,故答案为:NH4F;F原子半径比I原子小,H→F键比H→I键强(H→F更易形成),F-更易夺取NH4+中的H+;
(5). 同一周期中,随原子序数的增大,元素的第一电离能呈增大趋势,Be是4号元素,核外电子排布式为1s22s2,是一种全充满的稳定结构,所以第一电离能Be>B,N原子的核外电子排布式为:1s22s22p3,是一种半充满的稳定结构,所以第一电离能N>O,则第二周期中,第一电离能介于B元素和N元素间的元素为Be、C、O,故答案为:Be、C、O;
(6). 由表中数据可知,反应NO2(g) + CO(g)![]() CO2(g) + NO(g)的ΔH=(812+1076)kJ/mol-(1490+632)kJ/mol= -234kJ/mol,已知:①NO2(g) + CO(g)
CO2(g) + NO(g)的ΔH=(812+1076)kJ/mol-(1490+632)kJ/mol= -234kJ/mol,已知:①NO2(g) + CO(g)![]() CO2(g) + NO(g)的ΔH=-234kJ/mol、② N2(g)+O2(g)
CO2(g) + NO(g)的ΔH=-234kJ/mol、② N2(g)+O2(g) ![]() 2NO(g) ΔH=+179.5 kJ/mol、③ 2NO(g) +O2(g)
2NO(g) ΔH=+179.5 kJ/mol、③ 2NO(g) +O2(g)![]() 2NO2(g) ΔH=-112.3 kJ/mol,根据盖斯定律可知,①×2+③-②得:2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH= -759.8kJ/mol,故答案为:2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH= -759.8kJ/mol。
2NO2(g) ΔH=-112.3 kJ/mol,根据盖斯定律可知,①×2+③-②得:2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH= -759.8kJ/mol,故答案为:2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH= -759.8kJ/mol。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】将两个铂电极插入500mL CuSO4溶液中进行电解,通电一定时间后,某一电极增重0.064g(设电解时该电极无氢气析出,且不考虑水解和溶液体积变化),此时溶液中氢离子浓度约为
A. 4×10-3mol/L B. 2×10-3mol/L C. 1×10-3mol/L D. 1×10-7mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种Cu- Li可充电电池的工作原理如图所示,其中非水系电解液和水系电解液被锂离子固体电解质陶瓷片( LISICON)隔开。下列说法正确的是
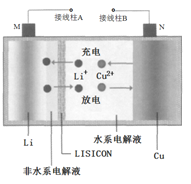
A. 陶瓷片允许水分子通过
B. 电池放电时,N极上发生氧化反应
C. 电池充电时,接线柱B应与外接直流电源的负极相连
D. 电池充电时,阴极反应为Li++e-=Li
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
①标准状况下,1LHCl和1LH2O的物质的量相同;
②标准状况下,11.2 LH2和14gN2所含原子数相同;
③28gCO 的体积约为22.4 L;
④两种物质的物质的量相同,则它们在标准状况下的体积相同;
⑤同温同体积时,气体物质的物质的量越大,则压强越大;
⑥同温同压下,气体的密度与气体的相对分子质量成正比。
A. ⑤⑥ B. ②③⑤⑥ C. ②⑤⑥ D. ①②④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有硫酸镁溶液500mL,它的密度是1.20g·cm3,其中镁离子的质量分数是4.8%,则有关该溶液的说法不正确的是
A. 溶质的质量分数是24% B. 溶液的物质的量浓度是2.4mol·L1
C. 溶质和溶剂的物质的量之比约为1∶21.1 D. 硫酸根离子的质量是230.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和H2的混和气体加热到1023K时,可建立下列平衡:CO2+H2![]() CO+H2O(g),在该温度下,平衡时有90%的氢气变成水蒸气(平衡常数K=1),则原混合气体中CO2和H2的分子数之比是( )
CO+H2O(g),在该温度下,平衡时有90%的氢气变成水蒸气(平衡常数K=1),则原混合气体中CO2和H2的分子数之比是( )
A. 9:1 B. 1:5 C. 1:10 D. 1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据所学知识回答下列问题:
酸 | 电离常数 |
CH3COOH | K = 1.8×10 -5 |
H2CO3 | K1= 4.3×10 -7,K2= 5.6×10 -11 |
H2SO3 | K1=1.54×10-2 ,K2=1.02×10-7 |
(1)NaHSO3溶液中共存在7种微粒,它们是Na+、HSO3-、H+、SO32-、H2O、________、_________(填微粒符号)。
(2)常温下,物质的量浓度相同的下列溶液 :
①NH4Cl ② NH4HCO3 ③(NH4)2SO4 ④ NH4HSO4
溶液中c(NH4+)最大的是:_________,最小的是:______(填序号)
(3)常温下,物质的量浓度均为0.1mol/L的六种溶液①NaOH、②NaCl、③Na2CO3、④H2SO3、⑤CH3COONa、⑥H2SO4,pH从大到小排列顺序为___________(填序号)
(4)常温时,AlCl3的水溶液呈酸性,原因是(用离子方程式表示):_____________把AlCl3溶液蒸干,灼烧,最后得到的固体产物主要是________(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中,甲、乙、丙、丁分别代表相应物质与水发生的化学反应。回答下列问题:
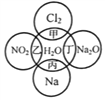
(1)甲、乙、丙、丁中,不属于氧化还原反应的是______________(用甲乙丙丁填空,下同),属于置换反应的是____________。
(2)写出丁反应中产物的化学式:______________,写出甲反应的化学方程式:________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com