
【题目】萘、四氢萘、十氢萘用途广泛,其转化关系为: ,该过程中能量变化如图所示,下列说法不正确的是:
,该过程中能量变化如图所示,下列说法不正确的是:

A.萘分子(![]() )的一氯代物有2种
)的一氯代物有2种
B.实线表示无催化剂的反应过程,虚线表示有催化剂的反应过程
C.E1、E2表示活化能,a的大小由E1决定,b的大小由E2决定
D.物质的稳定性:十氢萘>四氢萘>萘
科目:高中化学 来源: 题型:
【题目】在K2Cr2O7溶液中存在下列平衡:2CrO42—(黄色)+2H+![]() Cr2O72—(橙色)+H2O中,溶液颜色介于黄色和橙色之间,今欲使溶液颜色变成黄色,根据勒夏特列原理可以在溶液中加入( )
Cr2O72—(橙色)+H2O中,溶液颜色介于黄色和橙色之间,今欲使溶液颜色变成黄色,根据勒夏特列原理可以在溶液中加入( )
①H+ ②OH- ③K+ ④H2O
A.①③B.②④C.①④D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校科学兴趣小组探究二氧化碳与过氧化钠反应是否有氧气生成,设计了如图的实验,装置B中盛有饱和碳酸氢钠溶液,目的是除去二氧化碳中混有的氯化氢气体,E为收集氧气装置。
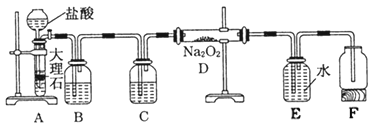
(1)C中盛有________,目的是________。
(2)写出装置D中发生反应的化学方程式___________。
(3)指出装置E的错误___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图1所示,已知有机物A,它的产量是衡量一个国家石油化工水平的标志,B和D都是日常生活食品中常见的有机物,E是具有浓郁香味、不易溶于水的油状液体,F是一种聚合物,生活中用于制造食物保鲜膜。

(1)写出B中官能团的电子式___;
(2)写出下列物质转化的化学方程式:
B→C:___;
B+D→E:___;
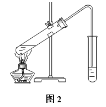
Ⅱ.(3)在实验室可以用如图2所示的装置进行B与D的反应,装置中通蒸气的导管要插在___溶液的液面上方,若要把制得的乙酸乙酯分离出来,应采用的实验操作是___。
Ⅲ.苹果醋是一种由苹果发酵而成的酸性饮品,具有解毒、降脂等药效。苹果酸是苹果醋的主要成分,其结构简式如图3所示:
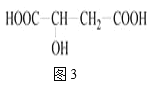
(4)1mol苹果酸与足量金属钠反应,能生成标准状况下的氢气___L。
(5)在一定条件下,苹果酸可能与下列哪些物质发生反应___?
A.氢氧化钠溶液 B.乙酸 C.碳酸氢钠溶液 D.乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。
I.已知反应![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]() Fe(s)+CO2(g)△H=-23.5kJmol-1,该反应在1000℃的平衡常数等于4。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,应经过l0min后达到平衡。
Fe(s)+CO2(g)△H=-23.5kJmol-1,该反应在1000℃的平衡常数等于4。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,应经过l0min后达到平衡。
(1)CO的平衡转化率=__;
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是__;
a.提高反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅱ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+2H2(g)![]() CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题:
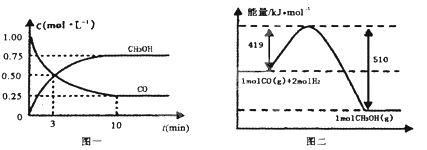
(3)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=___;
(4)已知氢气的燃烧热286kJ/mol,请写出甲醇气体不充分燃烧的热化学方程式___;
(5)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
容器 | 反应物投入的量 | 反应物的 转化率 | CH3OH 的浓度 | 能量变化(Q1、Q2、Q3均大于0) |
甲 | 1molCO和2molH2 | α1 | c1 | 放出Q1kJ热量 |
乙 | 1molCH3OH | α2 | c2 | 吸收Q2kJ热量 |
丙 | 2molCO和4molH2 | α3 | c3 | 放出Q3kJ热量 |
则下列关系正确的是___。
A.c1=c2 B.2Q1=Q3 C.2α1=α3 D.α/span>1+α2=1
E.该反应若生成1molCH3OH,则放出(Q1+Q2)kJ热量
Ⅲ.以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
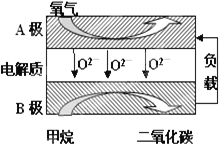
(6)B极上的电极反应式为___;
(7)若用该燃料电池做电源,用石墨做电极电解100mL1mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为__(标况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D 4种元素,前3种元素的离子都和氖原子具有相同的核外电子排布。A元素没有正化合价;B的氢化物分子式为H2B。0.2 mol的C单质能从酸中置换出2.24 L H2(标准状况)。D的原子核中没有中子。
(1)根据以上条件,判断A、B、C、D的元素名称:
A________,B________,C________,D________。
(2)用电子式表示C与A、C与B、B与D相互结合成的化合物,指出其化合物的类型及化学键类型:
①C+A2:电子式____________,化合物类型__________,化学键类型____________;
②C+B2:电子式____________,化合物类型__________,化学键类型____________;
③B+D2:电子式____________,化合物类型__________,化学键类型____________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,相同浓度的两种一元酸HX、HY分别用同一浓度的NaOH标准溶液滴定,滴定曲线如图所示。下列说法正确的是![]()
![]()
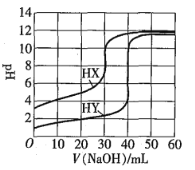
A.HX、HY起始溶液体积相同
B.均可用甲基橙作滴定指示剂
C.pH相同的两种酸溶液中:![]()
D.同浓度KX与HX的混合溶液中,粒子浓度间存在关系式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(N2H4)和次磷酸钠(NaH2PO2)都具有强还原性,都有着广泛的用途。
(1)已知:①N2H4(l)+O2(g)=N2(g)+2H2O(g) △H=-621.5 kJ·mol-1
②N2O4(l)=N2(g)+2O2(g) △H2=+204.3 kJ·mol-1
则火箭燃料的燃烧反应为2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) △H=________。
(2)已知反应N2H4(g)+ 2Cl2(g)N2(g)+4HCl(g),T°C时,向V L恒容密闭容器中加入2 mol N2H4(g)和4 mol Cl2(g),测得Cl2和HCl的浓度随时间的关系如图所示。

①0~ 10 min内,用N2(g)表示的平均反应速率v(N2)=_____________。
②M点时,N2H4的转化率为_____________(精确到0.1)%。
③T °C时,达到平衡后再向该容器中加入1.2 mol N2H4(g)、0.4 molCl2(g)、0. 8 mol N2 (g)、1.2 mol HCl(g) ,此时平衡_________________(填“正向移动”“逆向移动”或“不移动”)。
(3)①次磷酸(H3PO2)是一元酸,常温下1.0 mol·L-1的NaH2PO2溶液pH为8,则次磷酸的Ka=________。
②用次磷酸钠通过电渗析法制备次磷酸.装置如图所示。交换膜A属于_________(填“阳离子”或“阴离子”)交换膜,当电路中流过3.8528×105库仑电量时,制得次磷酸的物质的量为______(一个电子的电量为1.6×10- 19库仑,NA数值约为6. 02× 1023)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯丁酸氮芥是氮芥类抗癌药的代表物,其合成路线如图所示:
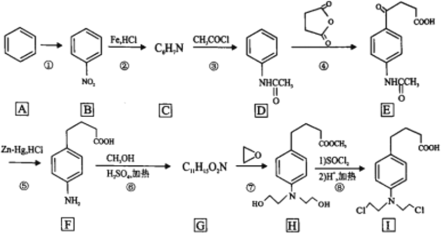
回答下列问题:
(1)反应①所需的试剂和条件是______________,B中的官能团名称是______________
(2)C的结构简式为______________。
(3)写出具有苯环结构,既能发生银镜反应又能发生水解反应的D的同分异构体的结构简式______________。(不考虑立体异构,只需写出3个)
(4)②的反应类型是______________。
(5)写出F到G的反应方程式______________。
(6)设计由苯和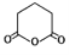 制备
制备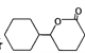 的合成路线(无机试剂任选)。______________
的合成路线(无机试剂任选)。______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com