
【题目】Ⅰ.如图1所示,已知有机物A,它的产量是衡量一个国家石油化工水平的标志,B和D都是日常生活食品中常见的有机物,E是具有浓郁香味、不易溶于水的油状液体,F是一种聚合物,生活中用于制造食物保鲜膜。

(1)写出B中官能团的电子式___;
(2)写出下列物质转化的化学方程式:
B→C:___;
B+D→E:___;
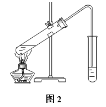
Ⅱ.(3)在实验室可以用如图2所示的装置进行B与D的反应,装置中通蒸气的导管要插在___溶液的液面上方,若要把制得的乙酸乙酯分离出来,应采用的实验操作是___。
Ⅲ.苹果醋是一种由苹果发酵而成的酸性饮品,具有解毒、降脂等药效。苹果酸是苹果醋的主要成分,其结构简式如图3所示:
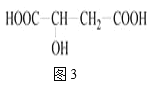
(4)1mol苹果酸与足量金属钠反应,能生成标准状况下的氢气___L。
(5)在一定条件下,苹果酸可能与下列哪些物质发生反应___?
A.氢氧化钠溶液 B.乙酸 C.碳酸氢钠溶液 D.乙醇
【答案】![]() 2CH3CH2OH+O2
2CH3CH2OH+O2![]() 2
2![]() +2H2O
+2H2O ![]() +HOC2H5
+HOC2H5![]()
![]() +H2O 饱和Na2CO3溶液 分液 33.6 ABCD
+H2O 饱和Na2CO3溶液 分液 33.6 ABCD
【解析】
Ⅰ有机物A的产量是衡量一个国家石油化工水平的标志,A是乙烯,则A和水发生加成得到乙醇,B为乙醇,乙醇发生催化氧化得到乙醛,乙醛再氧化得到乙酸,乙醇和乙酸发生酯化反应得到乙酸乙酯;F是一种聚合物,为A乙烯发生加聚反应得到,为聚乙烯。
Ⅰ(1)根据分析B为乙醇,其官能团为-OH,其电子式为![]() ;
;
(2)B生成C为乙醇的催化氧化,化学方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
B和D为乙醇和乙酸反应生成乙酸乙酯,醇脱去羟基中的H,酸脱去羧基中的羟基,化学方程式为CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;
Ⅱ(3)由于乙酸、乙醇均易发挥,因此乙酸乙酯中会含有乙酸、乙醇,可用饱和Na2CO3溶液,溶解乙醇,中和挥发出来的乙酸,也可以降低乙酸乙酯在水中的溶解度,为了防倒吸,导管不能插入液面以下;由于乙酸乙酯不溶于Na2CO3溶液,因此会分层,在上层,可以通过分液得到;
Ⅲ(4)苹果醋中的-OH、-COOH均可以与Na反应,因此1mol苹果醋与金属钠反应可以提供3molH,生成1.5molH2,其在标准状况下的体积为1.5mol×22.4L·mol-1=33.6L;
(5)苹果醋中含有-OH、-COOH;
A.苹果醋中含有-COOH,具有酸性,能够与NaOH反应,A符合题意;
B.苹果醋中含有-OH,可以与乙酸发生酯化反应,B符合题意;
C.苹果醋中含有-COOH,能够与NaHCO3溶液反应生成CO2,C符合题意;
D.苹果醋中含有-COOH,可以与乙醇发生酯化反应,D符合题意;
答案选ABCD。


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】下列物质之间有如下反应关系:
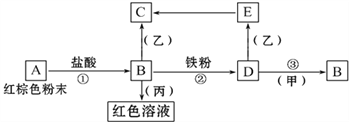
已知由E转化成C的现象是:灰白色沉淀迅速变为灰绿色,最后变为红褐色。
回答:
(1) 写出下列物质的化学式:A______B______D________甲_______乙_______丙__________
(2) 写出E→C反应的化学方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卫生部发出公告,自2011年5月1日起,禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂。CaO2和Na2O2在结构和性质上有很多相似的地方。请完成下列问题:
(1)CaO2属于____(填“离子化合物”或“共价化合物”),其电子式为_____,其阴、阳离子个数比为______。
(2)CaO2与水反应的化学方程式为______,生成1mol单质气体,转移的电子数为__________。(用NA代表阿伏加德罗常数)
(3)CaO2与二氧化碳反应的化学方程式为_________,该反应属于____________。
A.置换反应 B.氧化还原反应 C.复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某镍冶炼车间排放的漂洗废水中含有一定浓度的![]() 和
和![]() ,图甲是双膜三室电沉积法回收废水中的
,图甲是双膜三室电沉积法回收废水中的![]() 的示意图,图乙描述的是实验中阴极液pH值与镍回收率之间的关系。下列说法不正确的是()
的示意图,图乙描述的是实验中阴极液pH值与镍回收率之间的关系。下列说法不正确的是()![]() 镍的相对原子质量约为59)
镍的相对原子质量约为59)
图甲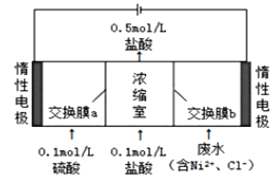 图乙
图乙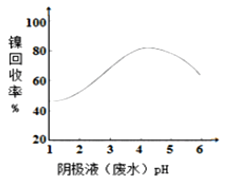
A.交换膜a为阳离子交换膜
B.浓缩室得到![]() 的盐酸时,阴极回收得到
的盐酸时,阴极回收得到![]() 镍
镍
C.阴极液![]() 时,镍的回收率低主要是有较多的
时,镍的回收率低主要是有较多的![]() 生成
生成
D.阳极反应式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D均为中学化学常见的纯净物,A是单质,它们有如图反应关系。下列说法错误的是( )

A.若A是大气中含量最多的气体,C、D是氧化物且会造成光化学污染。则D转化成C的反应化学方程为3NO2+H2O=2HNO3+2NO
B.若A、B、C分别为C(s)、CO(g)和CO2(g),且通过与O2(g)反应实现图示的转化。在同温同压且消耗含碳物质均为1mol时,反应①、②、③的焓变依次为△H 1、△H 2、△H 3,则它们之间的关系为 △H 2=△H 1+△H 3
C.若C为一元强碱且阴、阳离子所含的电子数相同,D为日常生活中常用的调味品,工业上用D制备A的化学方程式2Na2O(熔融)![]() 4Na+O2↑
4Na+O2↑
D.若A是应用最广泛的金属。④反应用到A,②、⑤反应均用到同一种气态非金属单质实验室保存D溶液的方法是加入适量铁粉与适量盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中,A为一种中学化学中常见的单质,B、C、D、E是含有A元素的常见化合物。它们的焰色实验均为黄色。

(1)写出下列物质的化学式:B___。
(2)以上6个反应中属于氧化还原反应的有___(填写编号)。
(3)写出A →C反应的离子方程式___。
(4)写出B→C反应的离子方程式:___;E→D的化学方程式:___。
(5)加热5.00gD和E的固体混合物,使E完全分解,固体混合物的质量减少了0.31g,则原混合物中D的质量分数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萘、四氢萘、十氢萘用途广泛,其转化关系为: ,该过程中能量变化如图所示,下列说法不正确的是:
,该过程中能量变化如图所示,下列说法不正确的是:

A.萘分子(![]() )的一氯代物有2种
)的一氯代物有2种
B.实线表示无催化剂的反应过程,虚线表示有催化剂的反应过程
C.E1、E2表示活化能,a的大小由E1决定,b的大小由E2决定
D.物质的稳定性:十氢萘>四氢萘>萘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组欲测定酸性条件下KClO3溶液与NaHSO3溶液反应的化学反应速率,所用的试剂为10mL 0.1mol/L KClO3溶液和10mL 0.3mol/L NaHSO3溶液,所得c(Cl-)随时间变化的曲线如图所示:

(1)根据实验数据可知,该反应在0~4min的平均反应速率v(Cl-)=______mol/(L·min)。
(2)反应过程中,该反应的化学反应速率变化趋势为先增大后减小。
i.探究化学反应速率增大的影响因素:
已知:ClO3-+3HSO3-=Cl-+3SO42-+3H+
方案 | 假设 | 具体实验操作 |
Ⅰ | 该反应放热,使溶液温度升高,反应速率加快 | 向烧杯中依次加入10mL 0.1mol/L KClO3溶液和10mL 0.3mol/L NaHSO3溶液,______。 |
Ⅱ | 反应产物Cl-对反应有催化作用 | 取10mL 0.1mol/L KClO3溶液于烧杯中,先加入_____固体(填化学式),再加入10mL 0.3mol/L NaHSO3溶液。 |
Ⅲ | 反应中溶液酸性增强,加快了化 学反应速率 | 分别向2个烧杯中加入10mL 0.1mol/L KClO3溶液, 烧杯①:加入1mL水烧杯②:加入1mL 0.2mol/L盐酸再分别向烧杯中加入10mL 0.3mol/L NaHSO3溶液。 |
(问题与思考)
①方案Ⅲ烧杯①中加入1mL水的作用是______。
②在证明方案Ⅰ假设不成立的情况下,从控制变量角度思考,方案III实验操作设计不严谨,改进措施为______。
③除方案Ⅰ、Ⅱ、Ⅲ外,请再提出一个可能使化学反应速率增大的假设_______。
ii.反应后期,化学反应速率降低的主要原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数用NA表示,下列叙述正确的是
A.18克液态水与18克冰中氢键数目均为NA
B.工业酸性废水中的Cr2O72-可转化为Cr3+除出,现用电解的方法模拟该过程,阴极为石墨,阳极为铁,理论上电路中每通过6mol电子,就有NA个Cr2O72-被还原
C.标准状况下,22.4LNO2含有的原子数小于3NA
D.1molLiAlH4在125℃完全分解成LiH、H2、Al,转移电子数为3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com