
【题目】某化学小组欲测定酸性条件下KClO3溶液与NaHSO3溶液反应的化学反应速率,所用的试剂为10mL 0.1mol/L KClO3溶液和10mL 0.3mol/L NaHSO3溶液,所得c(Cl-)随时间变化的曲线如图所示:

(1)根据实验数据可知,该反应在0~4min的平均反应速率v(Cl-)=______mol/(L·min)。
(2)反应过程中,该反应的化学反应速率变化趋势为先增大后减小。
i.探究化学反应速率增大的影响因素:
已知:ClO3-+3HSO3-=Cl-+3SO42-+3H+
方案 | 假设 | 具体实验操作 |
Ⅰ | 该反应放热,使溶液温度升高,反应速率加快 | 向烧杯中依次加入10mL 0.1mol/L KClO3溶液和10mL 0.3mol/L NaHSO3溶液,______。 |
Ⅱ | 反应产物Cl-对反应有催化作用 | 取10mL 0.1mol/L KClO3溶液于烧杯中,先加入_____固体(填化学式),再加入10mL 0.3mol/L NaHSO3溶液。 |
Ⅲ | 反应中溶液酸性增强,加快了化 学反应速率 | 分别向2个烧杯中加入10mL 0.1mol/L KClO3溶液, 烧杯①:加入1mL水烧杯②:加入1mL 0.2mol/L盐酸再分别向烧杯中加入10mL 0.3mol/L NaHSO3溶液。 |
(问题与思考)
①方案Ⅲ烧杯①中加入1mL水的作用是______。
②在证明方案Ⅰ假设不成立的情况下,从控制变量角度思考,方案III实验操作设计不严谨,改进措施为______。
③除方案Ⅰ、Ⅱ、Ⅲ外,请再提出一个可能使化学反应速率增大的假设_______。
ii.反应后期,化学反应速率降低的主要原因是______。
【答案】2.5×10-3 插入温度计 KCl或者NaCl 空白实验,消除由于体积变化带来的实验影响 将1mL水改为1mL0.2mol/L的KCl溶液(或NaCl溶液) 反应产物SO42-对反应有催化作用(或生成了SO42-加快了化学反应速率) 随着反应进行,反应物浓度降低,反应速率减慢
【解析】
(1)根据v=△c/△t计算;
(2)利用温度计测量溶液温度的变化;根据方案I、Ⅱ所对应的假设的变化分析;根据反应后溶液中的离子成分分析解答;根据氯离子可能会影响反应速率分析;根据浓度对反应速率的影响分析;
(1)根据实验数据可知,该反应在0~4min内生成氯离子的浓度是0.010mol/L,所以平均反应速率v(Cl-)=0.010mol/L÷4min=2.5×10-3mol/(L·min);
(2)①由于是假设该反应放热,使溶液温度升高,反应速率加快,因此需要测量反应过程中溶液温度的变化,则方案I中的实验操作为插入温度计;
②方案I、Ⅱ相比较Ⅱ探究反应产物Cl-对反应有催化作用,所以方案Ⅱ中的应加入Cl-,可加入KCl或者NaCl;
③由于反应中还有硫酸根离子生成,则除I、Ⅱ、Ⅲ中的假设外,还可以提出的假设是生成的硫酸根离子加快了化学反应速率;
④为防止氯离子对实验的干扰,则需要改进的措施是将1mL水改为1mL 0.2mol/L NaCl溶液;
⑤反应后期由于反应物浓度减小,因此化学反应速率变慢。


科目:高中化学 来源: 题型:
【题目】(1)在Na2SO4和Al2(SO4)3的混合溶液中,测得Al3+浓度为0.1 mol·L-1,加入等体积0.3 mol·L-1的BaCl2溶液恰好使![]() 完全沉淀,则混合溶液中Na+的浓度为________。
完全沉淀,则混合溶液中Na+的浓度为________。
(2)将0.1 mol·L-1的K2SO4溶液、0.2 mol·L-1的Al2(SO4)3溶液和纯水混合,要使混合液中K+、Al3+、![]() 的浓度分别为0.1 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,则K2SO4溶液、Al2(SO4)3溶液、纯水三者的体积比________(忽略体积的变化)。
的浓度分别为0.1 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,则K2SO4溶液、Al2(SO4)3溶液、纯水三者的体积比________(忽略体积的变化)。
(3)在标准状况下,将一个充满HCl气体和氧气的集气瓶倒放于盛水的水槽中,水面上升至集气瓶容积的![]() ,把集气瓶从水中取出(假设HCl全部留在集气瓶中),若溶液密度的变化忽略不计,则HCl的物质的量浓度为________ mol·L-1。
,把集气瓶从水中取出(假设HCl全部留在集气瓶中),若溶液密度的变化忽略不计,则HCl的物质的量浓度为________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图1所示,已知有机物A,它的产量是衡量一个国家石油化工水平的标志,B和D都是日常生活食品中常见的有机物,E是具有浓郁香味、不易溶于水的油状液体,F是一种聚合物,生活中用于制造食物保鲜膜。

(1)写出B中官能团的电子式___;
(2)写出下列物质转化的化学方程式:
B→C:___;
B+D→E:___;
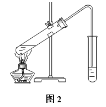
Ⅱ.(3)在实验室可以用如图2所示的装置进行B与D的反应,装置中通蒸气的导管要插在___溶液的液面上方,若要把制得的乙酸乙酯分离出来,应采用的实验操作是___。
Ⅲ.苹果醋是一种由苹果发酵而成的酸性饮品,具有解毒、降脂等药效。苹果酸是苹果醋的主要成分,其结构简式如图3所示:
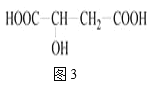
(4)1mol苹果酸与足量金属钠反应,能生成标准状况下的氢气___L。
(5)在一定条件下,苹果酸可能与下列哪些物质发生反应___?
A.氢氧化钠溶液 B.乙酸 C.碳酸氢钠溶液 D.乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D 4种元素,前3种元素的离子都和氖原子具有相同的核外电子排布。A元素没有正化合价;B的氢化物分子式为H2B。0.2 mol的C单质能从酸中置换出2.24 L H2(标准状况)。D的原子核中没有中子。
(1)根据以上条件,判断A、B、C、D的元素名称:
A________,B________,C________,D________。
(2)用电子式表示C与A、C与B、B与D相互结合成的化合物,指出其化合物的类型及化学键类型:
①C+A2:电子式____________,化合物类型__________,化学键类型____________;
②C+B2:电子式____________,化合物类型__________,化学键类型____________;
③B+D2:电子式____________,化合物类型__________,化学键类型____________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,相同浓度的两种一元酸HX、HY分别用同一浓度的NaOH标准溶液滴定,滴定曲线如图所示。下列说法正确的是![]()
![]()
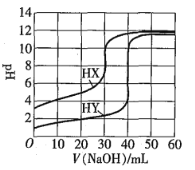
A.HX、HY起始溶液体积相同
B.均可用甲基橙作滴定指示剂
C.pH相同的两种酸溶液中:![]()
D.同浓度KX与HX的混合溶液中,粒子浓度间存在关系式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在150℃,由任意比例组成的混合气体1L,在9L过量的氧气中充分燃烧后,恢复到反应前的温度,体积仍为10L,则该混合气体的成分可能是
A. C2H4和C3H4B. CH4和C2H6C. CH4和C2H2D. C2H6和C3H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(N2H4)和次磷酸钠(NaH2PO2)都具有强还原性,都有着广泛的用途。
(1)已知:①N2H4(l)+O2(g)=N2(g)+2H2O(g) △H=-621.5 kJ·mol-1
②N2O4(l)=N2(g)+2O2(g) △H2=+204.3 kJ·mol-1
则火箭燃料的燃烧反应为2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) △H=________。
(2)已知反应N2H4(g)+ 2Cl2(g)N2(g)+4HCl(g),T°C时,向V L恒容密闭容器中加入2 mol N2H4(g)和4 mol Cl2(g),测得Cl2和HCl的浓度随时间的关系如图所示。

①0~ 10 min内,用N2(g)表示的平均反应速率v(N2)=_____________。
②M点时,N2H4的转化率为_____________(精确到0.1)%。
③T °C时,达到平衡后再向该容器中加入1.2 mol N2H4(g)、0.4 molCl2(g)、0. 8 mol N2 (g)、1.2 mol HCl(g) ,此时平衡_________________(填“正向移动”“逆向移动”或“不移动”)。
(3)①次磷酸(H3PO2)是一元酸,常温下1.0 mol·L-1的NaH2PO2溶液pH为8,则次磷酸的Ka=________。
②用次磷酸钠通过电渗析法制备次磷酸.装置如图所示。交换膜A属于_________(填“阳离子”或“阴离子”)交换膜,当电路中流过3.8528×105库仑电量时,制得次磷酸的物质的量为______(一个电子的电量为1.6×10- 19库仑,NA数值约为6. 02× 1023)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关铁的化合物的说法中,错误的是( )
A.Fe(OH)2是一种黑色固体,不稳定,在空气中易被氧化转变为红褐色
B.如图所示操作可制取Fe(OH)2
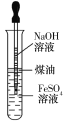
C.Fe3O4、Fe(OH)3都可以由化合反应制得
D.Fe(OH)3胶体呈红褐色、透明,能发生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家利用四种原子序数依次递增的短周期元素W、X、Y、Z“组合”成一种超分子,具有高效的催化性能,其分子结构示意图如图。W、X、Z分别位于不同周期,Z的原子半径在同周期元素中最大。(注:实线代表共价键,其他重复单元的W、X未标注)下列说法不正确的是( )
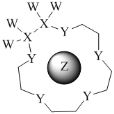
A.Y单质的氧化性在同主族中最强
B.离子半径:Z>Y
C.Z与Y可组成多种离子化合物
D.氢化物的热稳定性:Y>X
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com