
【题目】有关铁的化合物的说法中,错误的是( )
A.Fe(OH)2是一种黑色固体,不稳定,在空气中易被氧化转变为红褐色
B.如图所示操作可制取Fe(OH)2
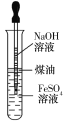
C.Fe3O4、Fe(OH)3都可以由化合反应制得
D.Fe(OH)3胶体呈红褐色、透明,能发生丁达尔效应
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】某镍冶炼车间排放的漂洗废水中含有一定浓度的![]() 和
和![]() ,图甲是双膜三室电沉积法回收废水中的
,图甲是双膜三室电沉积法回收废水中的![]() 的示意图,图乙描述的是实验中阴极液pH值与镍回收率之间的关系。下列说法不正确的是()
的示意图,图乙描述的是实验中阴极液pH值与镍回收率之间的关系。下列说法不正确的是()![]() 镍的相对原子质量约为59)
镍的相对原子质量约为59)
图甲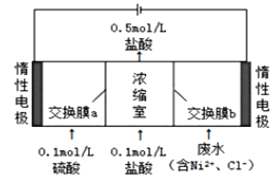 图乙
图乙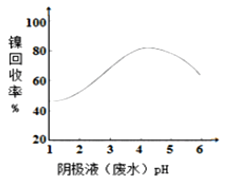
A.交换膜a为阳离子交换膜
B.浓缩室得到![]() 的盐酸时,阴极回收得到
的盐酸时,阴极回收得到![]() 镍
镍
C.阴极液![]() 时,镍的回收率低主要是有较多的
时,镍的回收率低主要是有较多的![]() 生成
生成
D.阳极反应式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组欲测定酸性条件下KClO3溶液与NaHSO3溶液反应的化学反应速率,所用的试剂为10mL 0.1mol/L KClO3溶液和10mL 0.3mol/L NaHSO3溶液,所得c(Cl-)随时间变化的曲线如图所示:

(1)根据实验数据可知,该反应在0~4min的平均反应速率v(Cl-)=______mol/(L·min)。
(2)反应过程中,该反应的化学反应速率变化趋势为先增大后减小。
i.探究化学反应速率增大的影响因素:
已知:ClO3-+3HSO3-=Cl-+3SO42-+3H+
方案 | 假设 | 具体实验操作 |
Ⅰ | 该反应放热,使溶液温度升高,反应速率加快 | 向烧杯中依次加入10mL 0.1mol/L KClO3溶液和10mL 0.3mol/L NaHSO3溶液,______。 |
Ⅱ | 反应产物Cl-对反应有催化作用 | 取10mL 0.1mol/L KClO3溶液于烧杯中,先加入_____固体(填化学式),再加入10mL 0.3mol/L NaHSO3溶液。 |
Ⅲ | 反应中溶液酸性增强,加快了化 学反应速率 | 分别向2个烧杯中加入10mL 0.1mol/L KClO3溶液, 烧杯①:加入1mL水烧杯②:加入1mL 0.2mol/L盐酸再分别向烧杯中加入10mL 0.3mol/L NaHSO3溶液。 |
(问题与思考)
①方案Ⅲ烧杯①中加入1mL水的作用是______。
②在证明方案Ⅰ假设不成立的情况下,从控制变量角度思考,方案III实验操作设计不严谨,改进措施为______。
③除方案Ⅰ、Ⅱ、Ⅲ外,请再提出一个可能使化学反应速率增大的假设_______。
ii.反应后期,化学反应速率降低的主要原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微粒有多种表示方式,下列各组不同表示方式一定代表同种微粒的是( )
A.C2H5Cl、CH3CH2ClB.OH﹣、![]()
C.![]() 、
、 D.C2H6O、CH3CH2OH
D.C2H6O、CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
弱酸 | CH3COOH | HCN | H2CO3 |
电离常数(25℃) | Ka = 1.8×10-5 | Ka=4.3×l0-10 | Ka1=5.0×l0-7 Ka2=5.6×l0-11 |
①常温下,pH相同的三种溶液:A.CH3COONa B.NaCN C.Na2CO3,其物质的量浓度由大到小的顺序是_______________(填编号)。
②将少量CO2通入NaCN溶液,反应的离子方程式是____________________________。
③室温下,-定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是__________________,溶液中c(CH3COO-)/c(CH3COOH) =___________
(2)室温下,用0.100 mol/L盐酸溶液滴定20.00mL0.l00mol/L 的某氨水溶液,滴定曲线如图所示(横坐标为盐酸的体积)。

① d点所示的溶液中离子浓度由大到小的顺序依次为__________________________________。
② b点所示的溶液中c(NH3·H2O)-c(NH4+)=________(用溶液中的其它离子浓度表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作步骤如下:
① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度以上
② 固定好滴定管并使滴定管尖嘴充满液体
④调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入2滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数。
填空:(1)以上步骤有错误的是(填编号)_________,该错误操作会导致测定结果__________。(填“偏大”、“偏小”或“无影响”)
(2)步骤⑤中,在记录滴定管液面读数时,滴定管尖嘴有气泡,导致测定结果____________。(填“偏大”、“偏小”或“无影响”)
(3)判断滴定终点的现象是:___________________________________;
(4)如下图是某次滴定时的滴定管中的液面,其读数为_________mL

(5)根据下列数据:请计算待测盐酸溶液的浓度:_______________________mol·L-1
滴定次数 | 待测液体积(mL) | 标准烧碱体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 4.00 | 24.00 |
第三次 | 20.00 | 2.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数用NA表示,下列叙述正确的是
A.18克液态水与18克冰中氢键数目均为NA
B.工业酸性废水中的Cr2O72-可转化为Cr3+除出,现用电解的方法模拟该过程,阴极为石墨,阳极为铁,理论上电路中每通过6mol电子,就有NA个Cr2O72-被还原
C.标准状况下,22.4LNO2含有的原子数小于3NA
D.1molLiAlH4在125℃完全分解成LiH、H2、Al,转移电子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知MnO![]() 、NO
、NO![]() 等在酸性条件下具有强氧化性,而S2-、I-、Fe2+等具有较强的还原性。下列水溶液中的各组离子因为发生氧化还原反应而不能大量共存的是( )
等在酸性条件下具有强氧化性,而S2-、I-、Fe2+等具有较强的还原性。下列水溶液中的各组离子因为发生氧化还原反应而不能大量共存的是( )
A. Na+、Ba2+、Cl-、SO42— B. MnO4-、K+、I-、H+
C. Ca2+、HCO3—、Cl-、K+ D. H+、Cl-、Na+、CO32—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA (g) + bB (s) ![]() cC (g) + dD (g)在反应过程中,其他条件不变,C的物质的量分数和T或P关系如图所示,下列叙述中正确的是( )
cC (g) + dD (g)在反应过程中,其他条件不变,C的物质的量分数和T或P关系如图所示,下列叙述中正确的是( )
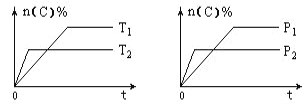
A. 温度降低,化学平衡向逆反应方向移动
B. 使用催化剂,C的物质的量分数增加
C. 化学方程式系数a <c+d
D. 无法根据图像确定改变温度后化学平衡移动方向
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com