
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
弱酸 | CH3COOH | HCN | H2CO3 |
电离常数(25℃) | Ka = 1.8×10-5 | Ka=4.3×l0-10 | Ka1=5.0×l0-7 Ka2=5.6×l0-11 |
①常温下,pH相同的三种溶液:A.CH3COONa B.NaCN C.Na2CO3,其物质的量浓度由大到小的顺序是_______________(填编号)。
②将少量CO2通入NaCN溶液,反应的离子方程式是____________________________。
③室温下,-定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是__________________,溶液中c(CH3COO-)/c(CH3COOH) =___________
(2)室温下,用0.100 mol/L盐酸溶液滴定20.00mL0.l00mol/L 的某氨水溶液,滴定曲线如图所示(横坐标为盐酸的体积)。

① d点所示的溶液中离子浓度由大到小的顺序依次为__________________________________。
② b点所示的溶液中c(NH3·H2O)-c(NH4+)=________(用溶液中的其它离子浓度表示)。
【答案】A B C CN-+CO2+H2O=HCN+HCO3- CH3COO-+H2O ![]() CH3COOH+OH- l.8×104 c(C1-)>c(NH4+)>c(H+)>c(OH-) 2c(H+)-2c(OH-)
CH3COOH+OH- l.8×104 c(C1-)>c(NH4+)>c(H+)>c(OH-) 2c(H+)-2c(OH-)
【解析】
先根据K分析酸强弱,根据越弱越水解分析盐的水解程度来得出水解相同氢氧根离子,其浓度大小顺序;
利用相对强的酸制相对弱的酸来分析;
离子发生水解,其离子浓度减小,根据电荷守恒和质子守恒来分析溶液中离子浓度的关系。
⑴根据K越大酸越强得出酸强弱顺序为CH3COOH > H2CO3 > HCN > HCO3-,pH相同,即水解生成的氢氧根浓度相同,水解程度越大,要使水解生成的氢氧根浓度相同,则盐的浓度越小,水解程度Na2CO3 > NaCN > CH3COONa,所以其物质的量浓度大小顺序为CH3COONa > NaCN > Na2CO3
故答案为A B C;
②将少量CO2通入NaCN溶液只能生成碳酸氢根,不能生成碳酸根,故反应的离子方程式是CN-+CO2+H2O=HCN+HCO3-,
故答案为CN-+CO2+H2O=HCN+HCO3-;
③室温下,-定浓度的CH3COONa溶液pH=9,溶液显碱性主要是醋酸根离子水解显碱性,用离子方程式表示溶液呈碱性的原因是CH3COO-+H2O ![]() CH3COOH+OH-,溶液中
CH3COOH+OH-,溶液中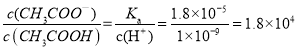 ,
,
故答案为CH3COO-+H2O ![]() CH3COOH+OH-;1.8×104;
CH3COOH+OH-;1.8×104;
⑵① d点所用盐酸的体积为20 mL,该点溶质为氯化铵,由于铵根离子水解,因此离子浓度由大到小的顺序依次为c(C1-)>c(NH4+)>c(H+)>c(OH-),
故答案为c(C1-)>c(NH4+)>c(H+)>c(OH-);
②b点所示的溶质为一水合氨和氯化铵且物质的量浓度相等,根据电荷守恒和质子守恒的得出c(NH4+) + c(H+) = c(C1-) + c(OH-),c(NH4+) + c(NH3·H2O) = 2c(C1-)
2c(NH4+) + 2c(H+) - 2c(OH-)= 2c(C1-) = c(NH4+) + c(NH3·H2O)
所以溶液中c(NH3·H2O)-c(NH4+)=2c(H+) - 2c(OH-),
故答案为2c(H+) - 2c(OH-)。


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】某校科学兴趣小组探究二氧化碳与过氧化钠反应是否有氧气生成,设计了如图的实验,装置B中盛有饱和碳酸氢钠溶液,目的是除去二氧化碳中混有的氯化氢气体,E为收集氧气装置。
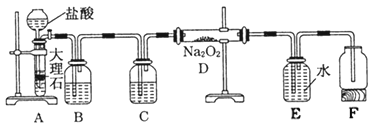
(1)C中盛有________,目的是________。
(2)写出装置D中发生反应的化学方程式___________。
(3)指出装置E的错误___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,相同浓度的两种一元酸HX、HY分别用同一浓度的NaOH标准溶液滴定,滴定曲线如图所示。下列说法正确的是![]()
![]()
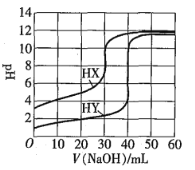
A.HX、HY起始溶液体积相同
B.均可用甲基橙作滴定指示剂
C.pH相同的两种酸溶液中:![]()
D.同浓度KX与HX的混合溶液中,粒子浓度间存在关系式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(N2H4)和次磷酸钠(NaH2PO2)都具有强还原性,都有着广泛的用途。
(1)已知:①N2H4(l)+O2(g)=N2(g)+2H2O(g) △H=-621.5 kJ·mol-1
②N2O4(l)=N2(g)+2O2(g) △H2=+204.3 kJ·mol-1
则火箭燃料的燃烧反应为2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) △H=________。
(2)已知反应N2H4(g)+ 2Cl2(g)N2(g)+4HCl(g),T°C时,向V L恒容密闭容器中加入2 mol N2H4(g)和4 mol Cl2(g),测得Cl2和HCl的浓度随时间的关系如图所示。

①0~ 10 min内,用N2(g)表示的平均反应速率v(N2)=_____________。
②M点时,N2H4的转化率为_____________(精确到0.1)%。
③T °C时,达到平衡后再向该容器中加入1.2 mol N2H4(g)、0.4 molCl2(g)、0. 8 mol N2 (g)、1.2 mol HCl(g) ,此时平衡_________________(填“正向移动”“逆向移动”或“不移动”)。
(3)①次磷酸(H3PO2)是一元酸,常温下1.0 mol·L-1的NaH2PO2溶液pH为8,则次磷酸的Ka=________。
②用次磷酸钠通过电渗析法制备次磷酸.装置如图所示。交换膜A属于_________(填“阳离子”或“阴离子”)交换膜,当电路中流过3.8528×105库仑电量时,制得次磷酸的物质的量为______(一个电子的电量为1.6×10- 19库仑,NA数值约为6. 02× 1023)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,用浓度为0.1000 mol·L-1的NaOH溶液滴定20.00 mL浓度均为0.1000 mol·L-1的三种酸HX、HY、HZ滴定曲线如图所示。下列说法正确的是
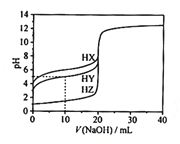
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX
B.根据滴定曲线,可得Ka(HY)≈10-6
C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(Na+)>c(H+)
D.HY与HZ混合,达到平衡时:c(H+)=c(Y-)+c(Z-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关铁的化合物的说法中,错误的是( )
A.Fe(OH)2是一种黑色固体,不稳定,在空气中易被氧化转变为红褐色
B.如图所示操作可制取Fe(OH)2
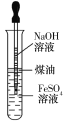
C.Fe3O4、Fe(OH)3都可以由化合反应制得
D.Fe(OH)3胶体呈红褐色、透明,能发生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三种气体X、Y、Z的相对分子质量关系为Mr(X)<Mr(Y)=0.5Mr(Z),下列说法正确的是
A.原子数目相等的三种气体,质量最大的是Z
B.同温同压下,同质量的三种气体,气体密度最小的是X
C.同温同压下,三种气体体积均为6.72 L,则它们的物质的量一定均为0.3 mol
D.同温下,体积相同的两容器分别充入2 g Y气体和1 g Z气体,则其压强比为2︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯丁酸氮芥是氮芥类抗癌药的代表物,其合成路线如图所示:
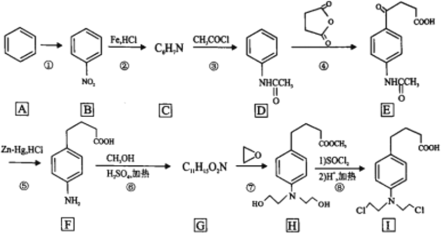
回答下列问题:
(1)反应①所需的试剂和条件是______________,B中的官能团名称是______________
(2)C的结构简式为______________。
(3)写出具有苯环结构,既能发生银镜反应又能发生水解反应的D的同分异构体的结构简式______________。(不考虑立体异构,只需写出3个)
(4)②的反应类型是______________。
(5)写出F到G的反应方程式______________。
(6)设计由苯和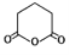 制备
制备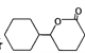 的合成路线(无机试剂任选)。______________
的合成路线(无机试剂任选)。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】他米巴罗汀(I)可用于治疗急性白血病,其合成研究具有重要意义,合成路线如图所示。
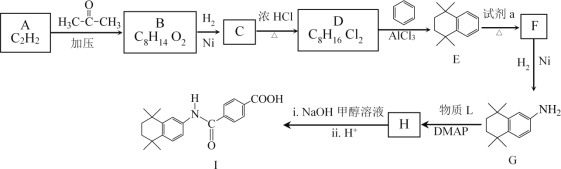
已知:i.HC![]() CH+
CH+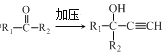
ii.R—NO2![]() R—NH2
R—NH2
iii.R1—NH2+![]() +HCl
+HCl
(1)A中官能团名称是_________。
(2)B的结构简式是________。
(3)D→E的化学方程式是__________。
(4)试剂a是_________。
(5)已知H在合成I的同时,还生成甲醇,G→H所加物质L的结构简式是______。
(6)B的一种同分异构体符合下列条件,其结构简式是________。
①能发生银镜反应
②核磁共振氢谱只有两组吸收峰
(7)D→E的过程中有多种副产物,其中属于高分子化合物的结构简式是_______。
(8)![]() 也是合成他米巴罗汀(I)的一种原料,合成路线如图所示。利用题中所给信息,中间产物的结构简式是_______________。
也是合成他米巴罗汀(I)的一种原料,合成路线如图所示。利用题中所给信息,中间产物的结构简式是_______________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com