
【题目】在25℃时,用浓度为0.1000 mol·L-1的NaOH溶液滴定20.00 mL浓度均为0.1000 mol·L-1的三种酸HX、HY、HZ滴定曲线如图所示。下列说法正确的是
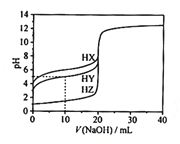
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX
B.根据滴定曲线,可得Ka(HY)≈10-6
C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(Na+)>c(H+)
D.HY与HZ混合,达到平衡时:c(H+)=c(Y-)+c(Z-)+c(OH-)
【答案】D
【解析】
A.三种酸浓度相同时,由于溶液的pH:HX>HY>HZ,pH越大,溶液的酸性越弱,酸电离产生的离子浓度越小,溶液的导电性越弱,所以在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ>HY>HX,错误;
B.根据滴定曲线,可得在开始滴定时,HY溶液的pH=3,c(H+)=10-3mol/L,根据电离平衡常数可得:![]() ,错误;
,错误;
C.根据图像可知酸性:HY>HX,所以将上述HX、HY溶液等体积混合后,用NaOH溶液滴定,首先是HY发生反应,然后是HX发生反应。当HX恰好完全反应时,HY已经完全发生反应。因此得到的溶液是NaY、NaX等浓度等体积的混合溶液。n(NaOH)=n(HX)+n(HY)。由于酸性HY>HX,所以水解程度X->Y-,X-、Y-水解消耗水电离产生的H+,使溶液显碱性,溶液中c(OH-)>c(H+);盐水解程度越大,剩余的离子浓度越小,所以离子浓度c(Y-)>c(X-);故微粒浓度大小关系是:c(Na+)>c(Y-)> c(X-)>c(OH-)>c(H+),错误;
D.HY、HZ都是弱酸,在溶液中存在电离平衡:HY![]() H++Y-;HZ
H++Y-;HZ![]() H++Z-,同时溶液中还存在水的电离平衡:H2O
H++Z-,同时溶液中还存在水的电离平衡:H2O![]() H++ OH-,所以达到平衡时:c(H+)=c(Y-)+c(Z-)+c(OH-) ,正确;
H++ OH-,所以达到平衡时:c(H+)=c(Y-)+c(Z-)+c(OH-) ,正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:
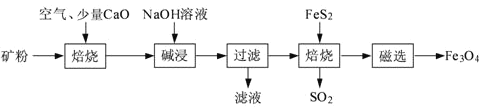
(1)粉碎高硫铝土矿石的目的是______。
(2)焙烧时发生氧化还原反应:______FeS2+______O2![]() ______Fe2O3+______SO2↑,配平该方程式。
______Fe2O3+______SO2↑,配平该方程式。
(3)碱浸时发生反应的化学方程式为______。
(4)过滤后向滤液中通入过量的CO2气体,反应的离子方程式为______。
(5)“过滤”得到的滤渣中含有大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2):n(Fe2O3)=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A,B,C,D都是周期表中的短周期元素,它们的核电荷数依次增大。A原子,C原子的L能层中,都有两个未成对的电子,C,D同主族。E,F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
(1)基态D原子中,电子占据的最高能层符号___,该能层具有的原子轨道数为__;
(2)E2+离子的价层电子排布图是__;
(3)A的最高价氧化物对应的水化物,其中心原子采取的轨道杂化方式为__,B的气态氢化物的VSEPR模型为__。
(4)DAB-的电子式为___;
(5)配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6。甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是一种重要金属:
(1)生产中曾用铝热反应焊接钢轨,则铝与氧化铁发生反应的化学方程式为:___
(2)铝与NaOH溶液反应的离子方程式为:___。
(3)工业上用铝土矿(主要成分为A12O3,还有少量的Fe2O3,SiO2等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如下:
①I和II步骤中分离溶液和沉淀的操作是;___;
②沉淀M中除含有泥沙外,一定还含有___,固体N是___;
③滤液X中,含铝元素的溶质的化学式为___,它属于___(填“酸”、“碱”或“盐”)类物质;
④实验室里常往AlCl3溶液中加入___(填“氨水”或“NaOH溶液”)来制取A1(OH)3。其反应的离子方程式为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有物质的量浓度均为0.1 mol/L的溶液①NH3·H2O ②CH3COOH ③KHSO4。下列有关离子浓度分析一定不正确的是( )
A.向①中逐滴加入少量②,![]() 逐渐增大
逐渐增大
B.①、③等体积混合后溶液中存在:NH4+ +H2O![]() NH3·H2O+H+
NH3·H2O+H+
C.①、②任意比混合:c(CH3COO-)+c(OH-)=c(H+)+c(NH4+ )
D.①、③按体积比2:1混合:c(NH4+)>c(NH3H2O)>c(SO42-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
弱酸 | CH3COOH | HCN | H2CO3 |
电离常数(25℃) | Ka = 1.8×10-5 | Ka=4.3×l0-10 | Ka1=5.0×l0-7 Ka2=5.6×l0-11 |
①常温下,pH相同的三种溶液:A.CH3COONa B.NaCN C.Na2CO3,其物质的量浓度由大到小的顺序是_______________(填编号)。
②将少量CO2通入NaCN溶液,反应的离子方程式是____________________________。
③室温下,-定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是__________________,溶液中c(CH3COO-)/c(CH3COOH) =___________
(2)室温下,用0.100 mol/L盐酸溶液滴定20.00mL0.l00mol/L 的某氨水溶液,滴定曲线如图所示(横坐标为盐酸的体积)。

① d点所示的溶液中离子浓度由大到小的顺序依次为__________________________________。
② b点所示的溶液中c(NH3·H2O)-c(NH4+)=________(用溶液中的其它离子浓度表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各组物质中,找出合适的序号填在对应的空格内:
①白磷和红磷;②NO2和N2O4;③12C和14C;④![]() 和
和 ![]() ;⑤C60和金刚石;⑥异戊烷和新戊烷 ;⑦
;⑤C60和金刚石;⑥异戊烷和新戊烷 ;⑦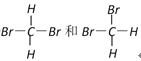
(1)互为同位素的是_____________;
(2)互为同分异构体的是__________;
(3)互为同素异形体的是_________;
(4)同一物质的是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种Ru络合物与g-C3N4复合光催化剂将CO,还原为HCOOH的原理图如图。
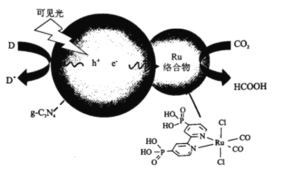
(1)基态碳原子的价电子排布图为___________。
(2)1molHCOOH中含有的σ键数目为___________,HCOOH的沸点比CO2高的原因为___________。
(3)Ru络合物中第二周期元素的第一电离能由大到小的顺序为___________。
(4)Ru络合物中与Ru配位的原子有N、___________。
(5)一类石墨的聚合物半导体g-C3N4,其单层平面结构如图1,晶胞结构如图2。
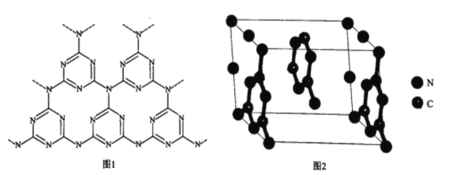
①g-C3N4中氮原子的杂化类型是______________。
②根据图2,在图1中用平行四边形画出一个最小重复单元。______________
③已知该晶胞的体积为Vcm3,中间层原子均在晶胞内部。设阿伏加德罗常数的值为NA,则g-C3N4的密度为______________g.cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、T、Q、Z 五种元素,位于元素周期表前四周期,元素的性质或结构信息如表:
元素 | 性质或结构信息 |
X | 单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼 |
Y | 基态原子的3p轨道上有4个电子 |
T | 原子核外s轨道电子总数等于p轨道电子总数;人体内含量最多的元素,且其单质是常见的助燃剂 |
Q | 第三周期主族元素中原子半径最小 |
Z | 基态原子的2价阳离子M层轨道全部排满电子 |
请根据上述信息回答下列问题:
(1)写出X3-的一种等电子体的化学式___;
(2)写出T元素基态原子的核外电子排布图___;
(3)元素X、T的电负性相比,___的小(填元素名称);元素X的第一电离能与T相比较,T的___(填“大”或“小”)。
(4)①Z元素在周期表中位于__区。Z单质晶体中Z原子在三维空间里的堆积方式为___堆积。
②Z的氯化物与氨水反应可形成配合物[Z(NH3)4(H2O)2]Cl2,该配合物加热时,首先失去配离中的配体是___(写化学式)。
(5)元素X与Q可形成化合物XQ3,根据价层电子对互斥理论判断XQ3的空间构型为___,分子中X原子的杂化方式为___杂化。
(6)Y与Z所形成化合物晶体的晶胞如图所示,该化合物的化学式为___。
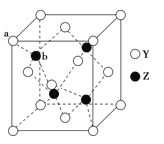
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com