
【题目】铝是一种重要金属:
(1)生产中曾用铝热反应焊接钢轨,则铝与氧化铁发生反应的化学方程式为:___
(2)铝与NaOH溶液反应的离子方程式为:___。
(3)工业上用铝土矿(主要成分为A12O3,还有少量的Fe2O3,SiO2等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如下:
①I和II步骤中分离溶液和沉淀的操作是;___;
②沉淀M中除含有泥沙外,一定还含有___,固体N是___;
③滤液X中,含铝元素的溶质的化学式为___,它属于___(填“酸”、“碱”或“盐”)类物质;
④实验室里常往AlCl3溶液中加入___(填“氨水”或“NaOH溶液”)来制取A1(OH)3。其反应的离子方程式为:___。
【答案】2Al+Fe2O3![]() Al2O3+2Fe 2Al+2OH﹣+2H2O=2AlO2+3H2↑ 过滤 Fe2O3 Al2O3 NaAlO2 盐 氨水 Al3++3NH3H2O═Al(OH)3↓+3NH4+
Al2O3+2Fe 2Al+2OH﹣+2H2O=2AlO2+3H2↑ 过滤 Fe2O3 Al2O3 NaAlO2 盐 氨水 Al3++3NH3H2O═Al(OH)3↓+3NH4+
【解析】
由流程图可知,铝土矿中氧化铝和二氧化硅与氢氧化钠溶液反应生成偏铝酸钠和硅酸钠,氧化铁不与氢氧化钠溶液反应,则过滤后得到的沉淀M为氧化铁,滤液X为偏铝酸钠和硅酸钠混合液;向混合液中通入二氧化碳,并控制溶液pH,偏铝酸钠与二氧化碳反应生成碳酸钠和氢氧化铝沉淀,则过滤后得到滤液Y为碳酸钠和硅酸钠混合液;洗净后的氢氧化铝加热分解生成氧化铝。
(1)铝与氧化铁在高温下发生铝热反应生成铁盒氧化铝,反应的化学方程式为:2Al+Fe2O3![]() Al2O3+2Fe,故答案为:2Al+Fe2O3
Al2O3+2Fe,故答案为:2Al+Fe2O3![]() Al2O3+2Fe;
Al2O3+2Fe;
(2)金属铝和氢氧化钠反应生成偏铝酸钠和氢气,反应的的离子方程式是:2Al+2OH﹣+2H2O=2AlO2+3H2↑,故答案为:2Al+2OH﹣+2H2O=2AlO2+3H2↑;
(3)①I和II步骤为分离溶液和沉淀的操作,该操作的名称为过滤,故答案为:过滤;
②沉淀M除含有泥沙外,主要是Fe2O3,氢氧化铝受热易分解生成氧化铝和水,所以固体N是Al2O3,故答案为:Fe2O3;Al2O3;
③滤液X中,含铝元素的溶质是偏铝酸钠,化学式为NaAlO2,属于盐类,故答案为:NaAlO2;盐;
④实验室里常往AlCl3溶液中加入氨水可以制取氢氧化铝,氢氧化铝不溶于弱碱,反应原理为:Al3++3NH3H2O═Al(OH)3↓+3NH4+,故答案为:氨水;Al3++3NH3H2O═Al(OH)3↓+3NH4+。


科目:高中化学 来源: 题型:
【题目】磷能形成多种单质或化合物。回答下列问题:
(1)白磷(P4)在氯气中燃烧产生大量白色烟雾,生成PCl3和PCl5。
①P4化学性质比N2活泼的主要原因是___________________________。
②形成PCl5时,P原子的一个3s电子激发到3d轨道后参与成键。写出该激发态原子的外围电子轨道表示式___________________________________。
③PCl5是一种白色固体,加压下于148℃液化,形成离子导体,其中阳离子为正四面体结构,阴离子为正八面体结构,该离子导体能导电的原因是_______(用电离方程式解释)。
(2)新型半导体材料 黑磷,是一种二维材料(结构如下图甲所示),其单层的结构如下图乙所示。
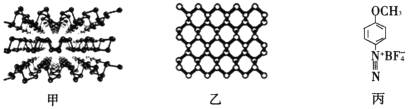
①黑磷中P原子的杂化方式为_____________________________。
②用4-甲氧基重氮苯四氟硼酸盐(如上图丙所示)处理黑磷纳米材料,可以保护和控制其性质。该盐的构成元素中N、O、F的电负性由大到小顺序为__________________,1mol该盐的阳离子含有的σ键的数目为____________(阿伏加德罗常数的值用NA表示,下同)。
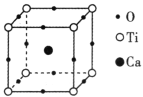
(3)中国科学院深圳先进技术研究院在钙钛矿/黑磷纳米复合材料的研究领域取得新进展,该材料表现出优异的光电应用潜力。如图所示为高温超导领域里的一种化合物 钙钛矿晶胞结构。若图中正方体边长为a nm,则该晶体的密度为____________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某浓度的H2A溶液中滴加NaOH溶液,若定义pc=-lgc,则测得pc(H2A)、pc(HA-)、pc(A2-)变化如图所示。下列说法错误的是( )
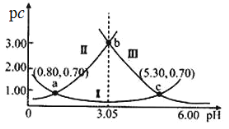
A.pH=3时溶液中c(A2-)>c(H2A)>c(HA-)
B.常温下,H2A的Ka1=10-0.80,Ka2=10-5.30
C.NaHA溶液中c(H+)>c(OH-)
D.从a点到c点,![]() 先增大后减小
先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学家侯德榜根据NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3、NH4Cl都小的性质,运用CO2+NH3+H2O+NaCl=NaHCO3↓+NH4Cl的反应原理制备纯碱.下面是在实验室进行模拟实验的生产流程示意图:气体A的饱和溶液![]() A和食盐的饱和溶液
A和食盐的饱和溶液![]() 悬浊液
悬浊液![]() 晶体
晶体![]() 纯碱,则下列叙述错误的是( )
纯碱,则下列叙述错误的是( )
A.A气体是CO2,B气体是NH3
B.第Ⅲ步得到的晶体是发酵粉的主要成分
C.第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒
D.第Ⅳ步操作的主要过程有溶解、蒸发、结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置完成相关实验,合理的是( )。

A. 图①:验证H2CO3酸性强于H2SiO3 B. 图②:收集CO2或NH3
C. 图③:分离Na2CO3溶液与CH3COOC2H5 D. 图④:分离C2H5OH与CH3COOC2H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用已知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作不正确的是( )
A.酸式滴定管用蒸馏水洗净后,直接加入已知浓度的盐酸
B.锥形瓶用蒸馏水洗净后,直接加入一定体积的未知浓度的NaOH溶液
C.滴定时,眼睛观察锥形瓶中溶液颜色的变化
D.读数时,视线与滴定管内液体的凹液面最低处保持水平
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组根据高中知识设计如下测定室内甲醛含量的装置(夹持装置已略)。

I.配制银氨溶液
⑴盛装AgNO3溶液的仪器D的名称_____________。
⑵关闭K2和K3,打开K1和分液漏斗活塞,将饱和食盐水滴入到圆底烧瓶中,当观察到D中最初生成的白色沉淀恰好完全溶解时,关闭K1和分液漏斗活塞。请写出A装置中发生反应的化学方程式_________;饱和食盐水的用途是________。
Ⅱ.测定室内空气中甲醛含量
⑶用热水浴加热D,打开K3,将滑动隔板由最左端抽到最右端,吸入1L室内空气,关闭K3,后续操作是_______________。
⑷装置中毛细管的作用是________________。
⑸已知甲醛被银氨溶液氧化的化学方程式为:HCHO+4Ag(NH3)2OH=(NH4)2CO3+4Ag↓+6NH3↑+2H2O,测得共生成Ag 2.16mg。则空气中甲醛的含量为_______mg.L-1(空气中其它物质不与银氨溶液反应)。
⑹该设计装置存在一个明显的不足之处是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的现象与结论相对应的是( )
A | B | C | D | |
实验 |
|
|
|
|
现象 | 一段时间后,a管液面高于b管液面 | 酸性KMnO4溶液褪色 | pH计测得①中pH大于②中pH | 试管①中有大量气泡,试管②中无现象 |
结论 | a管发生吸氧腐蚀,b管发生析氢腐蚀 | 有乙烯生成可以使酸性KMnO4溶液褪色 | 金属性:Mg>Al | 酸性:醋酸>碳酸>硼酸 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼化镁是迄今发现的临界温度最高的简单的金属化合物超导材料。回答下列问题:
(1)基态硼的电子排布图为__,基态镁原子的电子运动状态有__种。
(2)BF3的键角(填“大于”、“小于”或“等于”)__NF3的键角,理由是__。
(3)碱土金属的碳酸盐热分解反应模式为:MCO3(s)=MO(s)+CO2(g)。从结构的角度解释:MgCO3的热分解温度小于CaCO3的热分解温度的原因是__。
(4)已知硼化镁属六方晶系(如图1所示)a=b≠c,α=β=90°,γ=120°。又知硼化镁是一种插层型离子化合物,镁层和硼层交替排列;镁原子层呈三角形结构,硼原子层具有规则的六角蜂房结构,与石墨相似。硼化镁晶体沿z轴方向的投影如图2所示,黑球代表硼原子,白球代表镁原子。硼化镁的化学式为__;B的配位数是__。

(5)已知硼化镁的晶格常数为:a=b=0.3086nm,c=0.3524nm,则硼化镁晶体的密度表达式为__g/cm3(用NA表示阿伏加德罗常数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com