
【题目】某学习小组根据高中知识设计如下测定室内甲醛含量的装置(夹持装置已略)。

I.配制银氨溶液
⑴盛装AgNO3溶液的仪器D的名称_____________。
⑵关闭K2和K3,打开K1和分液漏斗活塞,将饱和食盐水滴入到圆底烧瓶中,当观察到D中最初生成的白色沉淀恰好完全溶解时,关闭K1和分液漏斗活塞。请写出A装置中发生反应的化学方程式_________;饱和食盐水的用途是________。
Ⅱ.测定室内空气中甲醛含量
⑶用热水浴加热D,打开K3,将滑动隔板由最左端抽到最右端,吸入1L室内空气,关闭K3,后续操作是_______________。
⑷装置中毛细管的作用是________________。
⑸已知甲醛被银氨溶液氧化的化学方程式为:HCHO+4Ag(NH3)2OH=(NH4)2CO3+4Ag↓+6NH3↑+2H2O,测得共生成Ag 2.16mg。则空气中甲醛的含量为_______mg.L-1(空气中其它物质不与银氨溶液反应)。
⑹该设计装置存在一个明显的不足之处是____________。
【答案】三颈烧瓶 Mg3N2+6H2O=3Mg(OH)2+2NH3↑ 减缓反应速率 打开K1,缓慢推动滑动隔板,将气体全部推出,再关闭K2 减少气体通入速率,使空气中甲醛气体被完全吸收 0.15 缺少尾气处理装置
【解析】
氮化镁和饱和食盐水反应生成氨气和氢氧化镁,氨气缓缓通入到硝酸银溶液中,先生成沉淀后沉淀溶解,停止通入氨气,吸入1L空气后缓缓压入到银氨溶液中,使甲醛与银氨溶液充分反应,根据生成的银的质量计算甲醛的物质的量,计算空气中甲醛的含量。
I⑴根据图中信息得知盛装AgNO3溶液的仪器D的名称三颈烧瓶;故答案为:三颈烧瓶。
⑵A装置中是氮化镁和水反应生成氢氧化镁和氨气,发生反应的化学方程式Mg3N2+6H2O =3Mg(OH)2+2NH3↑;饱和食盐水是降低水的浓度,其用途是减缓反应速率;故答案为:Mg3N2+6H2O=3Mg(OH)2+2NH3↑;减缓反应速率。
Ⅱ⑶用热水浴加热D,打开K3,将滑动隔板由最左端抽到最右端,吸入1L室内空气,关闭K3,主要是将空气中甲醛与银氨溶液反应,因此后续操作是打开K1,缓慢推动滑动隔板,将气体全部推出,再关闭K2;故答案为:打开K1,缓慢推动滑动隔板,将气体全部推出,再关闭K2。
⑷为了缓缓的通入空气到银氨溶液中,使空气中甲醛气体被完全吸收,因此装置中使用毛细管;故答案为:减少气体通入速率,使空气中甲醛气体被完全吸收。
⑸根据HCHO ~4Ag↓,测得共生成Ag 2.16mg即物质的量为2×105 mol,因此n(HCHO)=5×106 mol,则空气中甲醛的含量为![]() ;故答案为:0.15。
;故答案为:0.15。
⑹由于反应生成了氨气,氨气会污染环境,因此该设计装置存在一个明显的不足之处是缺少尾气处理装置;故答案为:缺少尾气处理装置。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为短周期主族元素,B、C、D在周期表中的位置关系如下图所示。A是短周期中原子半径最小的元素,A、B、C三种元素的原子序数之和等于D元素的原子序数,E是短周期中最活泼的金属元素。下列说法错误的是

A. 简单离子的半径大小关系:B>C>E
B. C元素的气态氢化物比D元素的气态氢化物稳定是氢键的缘故
C. 由A、B两种元素组成的离子化合物NH5中,阴、阳离子个数比为1:1
D. 由C、D、E三种元素组成的某种化合物,其水溶液能与盐酸反应产生沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入__。
(2)除去蒸馏水中溶解的O2常采用___的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是__。
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
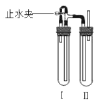
(1)在试管I里加入的试剂是___。
(2)在试管II里加入的试剂是___。
(3)为了制得白色Fe(OH)2沉淀,在试管I和II中加入试剂,打开止水夹,塞紧塞子后的实验步骤是:先___,后__。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是一种重要金属:
(1)生产中曾用铝热反应焊接钢轨,则铝与氧化铁发生反应的化学方程式为:___
(2)铝与NaOH溶液反应的离子方程式为:___。
(3)工业上用铝土矿(主要成分为A12O3,还有少量的Fe2O3,SiO2等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如下:
①I和II步骤中分离溶液和沉淀的操作是;___;
②沉淀M中除含有泥沙外,一定还含有___,固体N是___;
③滤液X中,含铝元素的溶质的化学式为___,它属于___(填“酸”、“碱”或“盐”)类物质;
④实验室里常往AlCl3溶液中加入___(填“氨水”或“NaOH溶液”)来制取A1(OH)3。其反应的离子方程式为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
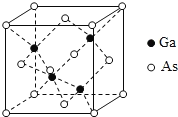
【题目】2019年1月3日上午,嫦娥四号探测器翩然落月,首次实现人类飞行器在月球背面的软着陆。所搭载的“玉兔二号”月球车,通过砷化镓(GaAs)太阳能电池提供能量进行工作。回答下列问题:
(1)基态As原子的价电子排布图为____________,基态Ga原子核外有________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJmol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为____和+3,砷的电负性比镓____(填“大”或“小”)。
(3)1918年美国人通过反应:HC≡CH+AsCl3![]() CHCl=CHAsCl2制造出路易斯毒气。在HC≡CH分子中σ键与π键数目之比为________;AsCl3分子的空间构型为___________。
CHCl=CHAsCl2制造出路易斯毒气。在HC≡CH分子中σ键与π键数目之比为________;AsCl3分子的空间构型为___________。
(4)砷化镓可由(CH3)3Ga和AsH3在700℃制得,(CH3)3Ga中碳原子的杂化方式为_______
(5)GaAs为原子晶体,密度为ρgcm-3,其晶胞结构如图所示, Ga与As以_______键键合。Ga和As的原子半径分别为a pm和b pm,设阿伏伽德罗常数的值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为_______________(列出计算式,可不化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.200 0 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00 mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞试液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答下列问题:
(1)以上步骤有错误的是____。若测定结果偏高,其原因可能是_____。
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装待测液的锥形瓶用蒸馏水洗过后未用待测液润洗
D.滴定管滴定前无气泡,滴定后有气泡
(2)判断滴定终点的现象是________。
(3)如图是某次滴定时的滴定管中的液面,其读数为_____mL。
![]()
(4)根据下列数据,请计算待测盐酸的浓度:_________mol·L-1。
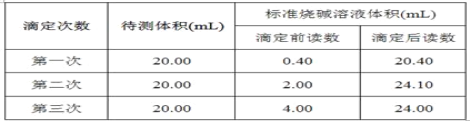
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向浓硫酸中分别加入下列三种固体,对实验现象的分析正确的是( )
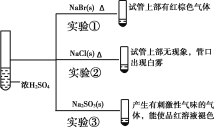
A.对比实验①和②可知还原性:Br->Cl-
B.对比实验①和③可知氧化性:Br2>SO2
C.对比实验②和③可知酸性:H2SO4>HCl>H2SO3
D.由实验可知浓硫酸具有强酸性、难挥发性、氧化性、脱水性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温常压下,24mLH2S和O2的混合气体点燃后,生成6mLSO2,则原混合气体中H2S的体积可能为
A. 10mLB. 12mLC. 16mLD. 18mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成一种熔合物,根据下列四种金属的熔沸点,其中不能形成合金的是
Na | Cu | Al | Fe | |
熔点/ | 97.5 | 1083 | 660 | 1535 |
沸点/ | 883 | 2595 | 2200 | 3000 |
A.Cu和AlB.Fe和CuC.Fe和NaD.A1和Na
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com